
В обзоре представлена имеющаяся информация по инспектированию производителей ветеринарных препаратов на соответствие требованиям Правил надлежащей производственной практики (Good Manufacturing Practice, GMP), которое проводят специалисты Органа инспекции Федерального государственного бюджетного учреждения «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ»).
Результаты инспектирования
Иностранные производители
В 2025 году специалисты ФГБУ «ВГНКИ» осуществили 29 выездных инспекций иностранных производителей ветеринарных препаратов в Австрии, Аргентине, Бразилии, Венгрии, Вьетнаме, Израиле, Индии, Испании, Италии, Китае, Нидерландах, Новой Зеландии, Уругвае, Франции и Швейцарии [1].
Последнее обновление государственного реестра заключений о соответствии производителя лекарственных средств для ветеринарного применения требованиям Правил GMP на сайте Россельхознадзора было 25.07.2025 г. [2]. Дополнительную информацию можно найти в системе «Гален» [3]. На сегодняшний день зарубежные производители имеют больше 50 действующих GMP-заключений.
Около четверти действующих GMP-заключений имеют площадки, расположенные в дружественных к России странах (в том числе в Аргентине, Беларуси, Бразилии, Индии и Китае). При этом количество ветеринарных препаратов из дружественных стран, зарегистрированных в России, за последние три года выросло в 2,1 раза: с 139 в 2023 году до 295 ветпрепаратов в 2025 году. Об этом в ноябре рассказал Тимур Чибиляев, исполнительный директор Национальной ветеринарной ассоциации (НВА) [4]. В 1,2 раза сократилось количество ветпрепаратов с действующими регистрационными удостоверениями из недружественных стран (с 750 до 579). Количество поставщиков из этих регионов снизилось в 3,7 раза.
Наибольшее количество действующих GMP-заключений принадлежит производственным площадкам, расположенным в Китае, Испании и США. Около 30% всех действующих заключений имеют площадки и СМО американских компаний Elanco и Zoetis (последняя входит в ассоциацию АВФАРМ) в разных странах. Исполнительный директор ассоциации АВФАРМ Семен Жаворонков отметил: «Более 30% общего числа GMP-инспекций проходят на площадках трех участников нашей ассоциации».

В соответствии с графиком проведения инспектирования, опубликованном на сайте ВГНКИ 16.12.2025 г. [5], в первом квартале 2026 года запланировано 4 инспекции производителей ветеринарных препаратов, площадки которых расположены в Китае, Сербии, Словакии и Франции.
Российские производители
С начала года в России зарегистрировали 103 ветеринарных препарата, сообщила в ноябре заместитель директора ФГБУ «ВГНКИ» Василина Грицюк [6]. В последние три года количество выведенных на рынок ветпрепаратов выросло в 2,1 раза: с 69 в 2022 году до 147 в 2024 году. Таким темпам способствовало упрощение процедуры регистрации отечественных препаратов для животных. Постановление Правительства РФ от 12.03.2022 г. № 353 «Об особенностях разрешительной деятельности в Российской Федерации» [7] устанавливает для отечественных ветеринарных препаратов, произведенных в целях импортозамещения, режим ускоренной процедуры государственной регистрации, не превышающий 60 рабочих дней и действующий до 31 декабря 2025 года. По ускоренной процедуре российские производители могут зарегистрировать все лекарственные препараты, кроме живых вакцин и иммунобиологических препаратов против особо опасных заболеваний животных. При этом предприятие обязательно должно иметь GMP-заключение.
На сегодняшний день отечественные производители имеют более 20 действующих GMP-заключений.
По данным аналитической компании RNC Pharma [8], по итогам 1-3 кварталов 2025 года доля отечественных производителей на розничном рынке ветеринарных препаратов в России (включая онлайн канал) продолжает увеличиваться — в отчетный период они формировали порядка 55% денежного объема, при этом их доля в натуральных единицах превысила 74%. При этом в России насчитывается 17 компаний, выпускающих лекарства как для животных, так и для людей.
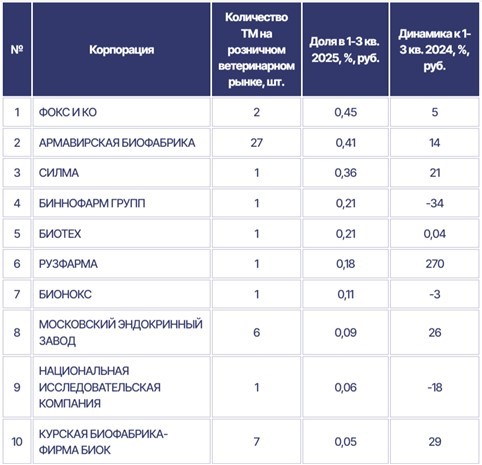
Доля российских ветеринарных вакцин на внутреннем рынке выросла до 72,6%, сообщил руководитель Россельхознадзора Сергей Данкверт в ходе открытого диалога в Совете Федерации [9]. «Сам факт зарубежного происхождения вакцин не гарантирует эффективности препаратов», -заметил он: «Например, не так давно пришлось закрыть крупные поставки вакцин для птиц из Израиля, потому что производитель не прошел инспекцию на соответствие требованиям Правил GMP».
Прошедшие события и мероприятия
В ноябре-декабре этого года прошло несколько событий и мероприятий, которые могли бы быть интересны производителям, готовящимся к инспектированию.
В начале ноября стало известно, что Правительство РФ приняло Постановление от 29.10.2025 г. № 1681 «Об установлении размера платы за выдачу сертификатов (заключений) соответствия производства лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики Евразийского экономического союза» [10]. Размер платы за выдачу ЕАЭС GMP-сертификатов производителям ветеринарных препаратов составляет 23 300 рублей. Постановление вступит в силу с 1 марта 2026 года.
В ноябре Правительство РФ приняло Постановление от 08.11.2025 г. № 1766 «О признании утратившими силу некоторых актов Правительства Российской Федерации» [11]. В частности, в соответствии с принятым Постановлением, с 1 марта 2026 года утрачивает силу Постановление Правительства РФ от 03.12.2015 г. № 1314 «Об определении соответствия производителей лекарственных средств требованиям правил надлежащей производственной практики» [12]. Следует отметить [13], что с 1 марта 2026 года должно начаться проведение фармацевтических инспекций по Правилам ЕАЭС с выдачей GMP-сертификатов (Приложение № 26 к Решению Совета ЕЭК от 21.01.2022 г. № 1 «О Правилах регулирования обращения ветеринарных лекарственных средств на таможенной территории Евразийского экономического союза») [14].
В том же месяце Евразийская академия надлежащих практик провела бесплатный вебинар «Внедрение ИИ в фармацевтической индустрии в контексте GMP» [15]. Ведущие вебинара Константин Кошечкин и Руслан Калашников сосредоточились на конкретных, работающих кейсах применения искусственного интеллекта (ИИ) в условиях строгого регулирования GMP.

Напомним, что в июле этого года был опубликован проект Приложения 22 к EU GMP «Искусственный интеллект» [16, 17]. В свете стремительного развития цифровых технологий и внедрения систем ИИ в фармацевтическое производство обновление руководств GMP имеет решающее значение для обеспечения того, чтобы они продолжали предоставлять четкие, практичные и актуальные рекомендации для производителей и национальных компетентных органов. Новое Приложение по ИИ устанавливает требования к использованию ИИ и машинного обучения в производстве активных субстанций и лекарственных препаратов. Оно устанавливает требования к выбору, обучению и валидации ИИ-моделей. Особое внимание уделяется определению предполагаемого использования модели, установлению показателей эффективности, качеству данных для обучения модели, а также управлению и обработке данных испытаний. Приложение 22 предусматривает непрерывный надзор за системами ИИ, включая контроль изменений, мониторинг эффективности моделей и процедуры проверки человеком при необходимости [18].
В конце ноября в Москве состоялась международная выставка оборудования, сырья и технологий для фармацевтического производства Pharmtech & Ingredients 2025. В первый день работы выставки прошло несколько полезных мероприятий [19]. Выступая на дискуссионной сессии «ColdChain: логистика фармы», Тадзио Шиллинг, генеральный директор Ассоциации европейского бизнеса (АЕБ) рассказал про вызовы и перспективы логистики мед- и ветеринарных препаратов. Он отметил, что и в России, и в западных странах фармацевтическая отрасль, и здравоохранение в целом, воспринимается как особо важный сектор, благодаря чему, несмотря на внешние вызовы, иностранные компании продолжают свою работу в России. Анна Филиппова, директор по развитию фармацевтического сектора WELLGO, рассказала об особенностях логистики фармы разными видами транспорта. Андрей Кухаренко, директор по развитию компании «Технологии Холодовой Цепи» рассказал про применение искусственного интеллекта в логистике холодовой цепи лекарственных средств.

О холодовой цепи лекарственных средств вы можете дополнительно прочитать здесь.
Также в рамках деловой программы выставки состоялся круглый стол, посвященный рынку ветеринарных препаратов — «От импортозамещения к технологическому лидерству. Новые вызовы для российской ветеринарной фармы». Тимур Чибиляев представил отчет о производстве ветеринарных препаратов. Он подчеркнул, что растет интерес медицинского сектора к ветеринарной отрасли. Семен Жаворонков выступил с докладом «Ветпрепараты международных производителей в ЕАЭС: новые вызовы и перспективы». Эксперт отметил, что зарубежные поставки в Россию продолжают восстанавливаться после ужесточений условий доступа. В конце выступления он заключил, что на бизнес сегодня влияют:
- приведение регистрационных досье в соответствие;
- подготовка к прохождению совместных GMP-инспекций.
В декабре в Москве Учебный центр ДжиЭксПи провел «Форум специалистов по валидации». Мероприятие собрало специалистов из различных отраслей фармацевтической промышленности, занятых в процессах валидации. Форум стал уникальной площадкой для обмена опытом, обсуждения актуальных вопросов и трендов в области валидации, а также для поиска новых идей и решений.
Вызовы в 2026 году
Как уже было отмечено выше, подготовка к прохождению совместных GMP-инспекций в рамках ЕАЭС является одним из главных вызовов следующего года. Некоторые вопросы от производителей ветеринарных препаратов уже были озвучены на X Всероссийской GMP-конференции [20] во время панельной сессии «Общий рынок лекарственных средств для ветеринарного применения ЕАЭС» [21]:
- Практическая реализация механизма совместных инспекций — когда состоятся первые инспекции по Приложению № 26 к Решению Совета ЕЭК от 21.01.2022 г. № 1 [14]?
- Как будет реализован механизм заключения договора(-ов) с инспекторатами: расчет стоимости инспектирования, порядок заключения договоров?
- Возможно ли увеличение срока, отведенного на подготовку САРА-плана?
- Сроки проведения инспекции: есть ли возможность зафиксировать предельный срок проведения совместной инспекции с момента принятия решения?
Предложения экспертов к Приложению № 26 к Решению Совета ЕЭК от 21.01.2022 г. № 1 были представлены в этом году во время рабочей встречи на площадке Российского союза промышленников и предпринимателей (РСПП) [22].
Это последний обзор, посвященный российским GMP-инспекциям производителей ветпрепаратов. Производителям рекомендуется принимать активное участие в событиях и мероприятиях, связанных с GM(D)P, и тщательнее готовиться к инспектированию. Мы желаем им терпения и удачи в Новом году!

Федеральное государственное бюджетное учреждение «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов», ФГБУ «ВГНКИ» — учреждение, уполномоченное на проведение инспектирования производителей лекарственных средств для ветеринарного применения, производство которых осуществляется за пределами Российской Федерации, на соответствие требованиям Правил GMP
Национальная ветеринарная ассоциация, НВА — некоммерческая организация, которая является коллаборацией ключевых биофармацевтических компаний
Ассоциация ветеринарных фармацевтических производителей АВФАРМ — ассоциация, представляющая на территории Российской Федерации интересы ведущих международных фармацевтических компаний-производителей лекарственных средств для ветеринарного применения (MSD Animal Health, Zoetis и Boehringer Ingelheim)
Ассоциация европейского бизнеса, АЕБ — независимая некоммерческая организация, объединяющая более 380 компаний, работающих в России, основное представительство иностранных инвесторов в России
Ссылки:
- ФГБУ «ВГНКИ» / Пресс-центр / Новости / ФГБУ «ВГНКИ» провело 29 инспекций иностранных производителей ветпрепаратов в текущем году. URL: https://www.vgnki.ru/fgbu-vgnki-provelo-29-inspekcij-inostrannyh-proizvoditelej-vetpreparatov-v-tekushhem-godu.html (дата обращения 20.12.2025)
- Россельхознадзор / Деятельность / Госуслуги / Выдача заключения о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики / Дополнительная информация для заявителя / Государственный реестр заключений о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики. URL: https://fsvps.gov.ru/files/gosudarstvennyj-reestr-zakljuchenij-o-sootvetstvii-proizvoditelja-inostrannogo-proizvoditelja-lekarstvennyh-sredstv-dlja-veterinarnogo-primenenija-trebovanijam-pravil-nadlezhashhej-proizvodstvennoj-pr/ (дата обращения 20.12.2025)
- Автоматизированная система Гален / Заключения GMP / Государственный реестр заключений о соответствии производителя (иностранного производителя) лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики. URL: https://galen.vetrf.ru/react/registry/gmp/registry (дата обращения 20.12.2025)
- Ветеринария и жизнь / Наука и технологии / Ветпрепаратов из дружественных стран за три года стало больше в два раза. URL: https://vetandlife.ru/pet-business/vetpreparatov-iz-druzhestvennyh-stran-za-tri-goda-stalo-bolshe-v-dva-raza/ (дата обращения 20.12.2025)
- ФГБУ «ВГНКИ» / Структура / Отдел инспекции производства на соответствие требованиям надлежащей производственной практики / График проведения инспектирования иностранных производителей на соответствие требованиям надлежащей производственной практики. URL: https://www.vgnki.ru/assets/2025/files/grafik-na-sajt-16122025.pdf (дата обращения 20.12.2025)
- Ветеринария и жизнь / Зообизнес / Сколько новых лекарств для животных зарегистрировали в РФ в 2025 году. URL: https://vetandlife.ru/pet-business/skolko-novyh-lekarstv-dlya-zhivotnyh-zaregistrirovali-v-rf-v-2025-godu/ (дата обращения 20.12.2025)
- КонсультантПлюс / Постановление Правительства РФ от 12.03.2022 N 353 (ред. от 02.10.2025) «Об особенностях разрешительной деятельности в Российской Федерации». URL: https://www.consultant.ru/document/cons_doc_LAW_411447/ (дата обращения 20.12.2025)
- RNC Pharma / Российские фармпроизводители обеспечивают порядка 2,2% от денежного объема ветеринарной розницы и сильно отстают от профильных игроков с точки зрения динамики продаж. URL: https://rncph.ru/blog/191125/ (дата обращения 20.12.2025)
- Ветеринария и жизнь / Новости / Доля отечественных ветеринарных вакцин достигла 72,6% — Россельхознадзор. URL: https://vetandlife.ru/livestock/dolya-otechestvennyh-veterinarnyh-vakcin-dostigla-72-6-rosselhoznadzor/ (дата обращения 20.12.2025)
- КонсультантПлюс / Постановление Правительства РФ от 29.10.2025 N 1681 «Об установлении размера платы за выдачу сертификатов (заключений) соответствия производства лекарственных средств для ветеринарного применения требованиям правил надлежащей производственной практики Евразийского экономического союза». URL: https://www.consultant.ru/document/cons_doc_LAW_518017/ (дата обращения 20.12.2025)
- КонсультантПлюс / Постановление Правительства РФ от 08.11.2025 N 1766 «О признании утратившими силу некоторых актов Правительства Российской Федерации». URL: https://www.consultant.ru/document/cons_doc_LAW_518691/ (дата обращения 20.12.2025)
- КонсультантПлюс / Постановление Правительства РФ от 03.12.2015 N 1314 (ред. от 05.09.2020) «Об определении соответствия производителей лекарственных средств требованиям правил надлежащей производственной практики» (вместе с «Правилами организации и проведения инспектирования производителей лекарственных средств на соответствие требованиям правил надлежащей производственной практики, а также выдачи заключений о соответствии производителя лекарственных средств указанным требованиям»). URL: https://www.consultant.ru/document/cons_doc_LAW_190256/ (дата обращения 20.12.2025)
- ФармПром.РФ / Регуляторы фармрынка / Изменения в правилах GMP-инспектирования производителей лекарственных средств. URL: https://pharmprom.news/izmeneniya-v-pravilax-gmp-inspektirovaniya-proizvoditelej-lekarstvennyx-sredstv/ (дата обращения 20.12.2025)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 21.01.2022 № 1 «О Правилах регулирования обращения ветеринарных лекарственных средств на таможенной территории Евразийского экономического союза. URL: https://docs.eaeunion.org/Pages/DisplayDocument.aspx?s=%7Be1f13d1d-5914-465c-835f-2aa3762eddda%7D&w=9260b414-defe-45cc-88a3-eb5c73238076&l=%7B8a412e96-924f-4b3c-8321-0d5e767e5f91%7D&EntityID=32004 (дата обращения 20.12.2025)
- Евразийская Академия надлежащих практик / Образовательная деятельность / Вебинары / Внедрение ИИ в фармацевтической индустрии в контексте GMP. URL: https://gxp-academy.org/education/webinars/vnedrenie-ii-v-farmatsevticheskoy-industrii-v-kontekste-gmp/ (дата обращения 20.12.2025)
- ФармПром.РФ / Фарминдустрия в мире / Искуственный интеллект в европейских правилах GMP — Обзор проекта Приложения 22. URL: https://pharmprom.news/iskustvennyj-intellekt-v-evropejskix-pravilax-gmp-obzor-proekta-prilozheniya-22/ (дата обращения 20.12.2025)
- EC / Draft guidelines: New annex 22 — Artificial intelligence. URL: https://health.ec.europa.eu/document/download/5f38a92d-bb8e-4264-8898-ea076e926db6_en?filename=mp_vol4_chap4_annex22_consultation_guideline_en.pdf (дата обращения 20.12.2025)
- EC / Stakeholders’ Consultation on EudraLex Volume 4 — Good Manufacturing Practice Guidelines: Chapter 4, Annex 11 and New Annex 22. URL: https://health.ec.europa.eu/consultations/stakeholders-consultation-eudralex-volume-4-good-manufacturing-practice-guidelines-chapter-4-annex_en (дата обращения 20.12.2025)
- Pharmtech & Ingredients / Итоги первого дня работы выставки Pharmtech & Ingredients 2025. URL: https://pharmtech-expo.ru/ru/media/news/2025/november/25/pharmtech-2025-itogi-pervogo-dnya/ (дата обращения 20.12.2025)
- X Всероссийская GMP-конференция. URL: http://gosgmp.ru/ (дата обращения 20.12.2025)
- ФармПром.РФ / Новости фармацевтической отрасли / Сессия «Общий рынок лекарственных средств для ветеринарного применения ЕАЭС» на Всероссийской GMP-конференции 2025. URL: https://pharmprom.news/sessiya-obshhij-rynok-lekarstvennyx-sredstv-dlya-veterinarnogo-primeneniya-eaes-na-gmp-konferencii-2025/ (дата обращения 20.12.2025)
- Фармпром / Репортаж / Эксперты предлагают изменения в правила регулирования ветеринарных лекарств в ЕАЭС. URL: https://pharmprom.news/eksperty-predlagayut-izmeneniya-v-pravila-regulirovaniya-veterinarnyx-lekarstv-eaes/ (дата обращения 20.12.2025)

