
Лекарственные средства, изменяющие свои свойства под действием температуры окружающей среды, являются термочувствительными. Температура хранения и транспортировки такой продукции может меняться, что может повлиять на ее стабильность, пути и кинетику деградации, приводя к потере продуктом своих критически важных характеристик качества. Холодовая цепь (cold chain) — это система хранения и транспортировки чувствительной к температуре и времени продукции при установленных температурах от места производства до места назначения. Принципы управления температурой также применяются при производстве продуктов, безопасность и эффективность применения которых обеспечивается системой холодовой цепи.
Системный, стандартизированный и эффективный подход к управлению температурой во время производства, хранения и дистрибьюции необходим для обеспечения качества продукции, безопасности и непрерывности поставок, а также для соблюдения нормативных требований. Принципы управления холодовой цепью устанавливаются на различных этапах для минимизации воздействия ненадлежащих условий хранения на продукцию, например:
- управление транспортировкой;
- квалифицированные конфигурации упаковки/транспортировки;
- «время нахождения вне хранилища» (Time Out of Storage, TOS), мониторинг температуры и/или мониторинг времени транспортировки;
- управление температурными выходами.
Процесс управления холодовой цепью можно представить следующим образом:
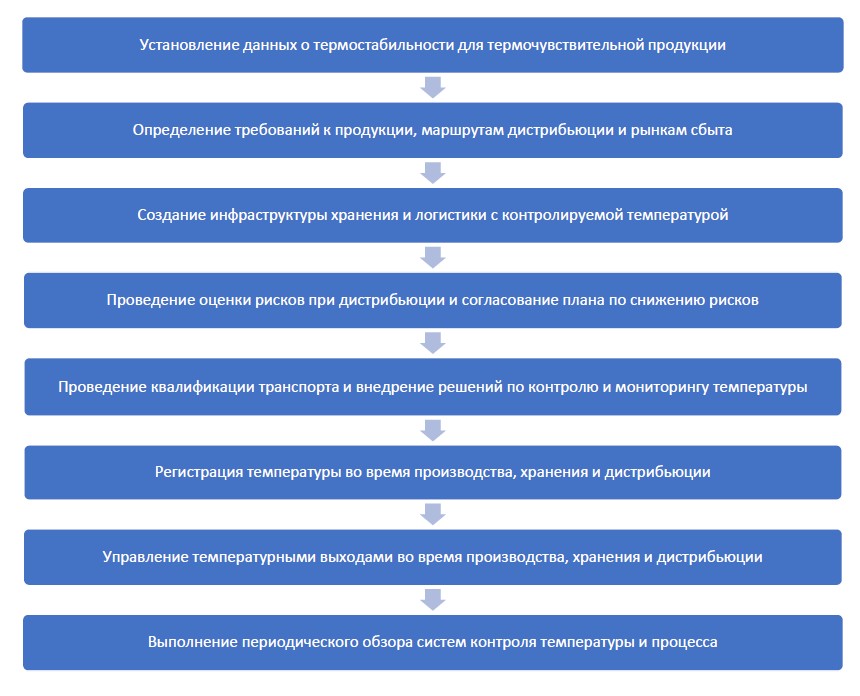
Установление данных о термостабильности для термочувствительной продукции
Термостабильность лекарственного препарата — это способность препарата сохранять свои физические и химические свойства при определенной температуре. Данные о термостабильности относятся к конкретному продукту и основаны на дополнительных данных, таких как:
- испытания, включающие циклические изменения температуры (Temperature Cycling Studies, TCS);
- ускоренные испытания стабильности;
- технические обоснования.
Цель данного этапа — получить данные о термостабильности продукции для установления соответствующих предписанных (зарегистрированных) температурных пределов/температурных пределов при транспортировке. Исследования термостабильности предоставляют данные, которые позволяют определить температурные условия, необходимые для хранения и дистрибьюции продукта, а также обосновать решение о его дальнейшей судьбе в случае температурных выходов.
Определение требований к продукции, маршрутам дистрибьюции и рынкам сбыта
Цель данного этапа — определить требования к распределению времени и температуры на основе данных о термостабильности продукта, а также спецификаций хранения и транспортировки, чтобы продукт соответствовал действующим нормам. При разработке стратегии хранения и дистрибьюции с контролируемой температурой необходимо учитывать следующее:
- регуляторные требования рынка в соответствии с зарегистрированными документами о продукте (условия хранения и дистрибьюции);
- политика регулирующих органов на конкретном рынке, т. е. любые требования к мониторингу температуры во время транспортировки и приемлемость температурных выходов;
- руководящие принципы надлежащей дистрибьюторской практики (Good Distribution Practice, GDP), принятые соответствующими странами;
- соблюдение нормативных документов в сфере торговли, регулирующих процесс экспорта и импорта соответствующих стран;
- требования безопасности.
В Техническом отчете TR 53 «Руководство для отрасли: Исследование стабильности для поддержки дистрибьюции новых лекарственных препаратов» (Guidance for Industry: Stability Testing to Support Distribution of New Drug Products) [1], изданном Ассоциацией производителей парентеральных лекарственных средств (PDA), для каждого продукта рекомендуется устанавливать так называемый «запас стабильности» (Stability Budget). При наличии данных о термостабильности их необходимо распределить по каждому этапу производства/цепочки поставок для учета кумулятивных температурных выходов следующим образом:
- для продукции, безопасность и эффективность применения которой обеспечивается системой холодовой цепи, «запас стабильности» должен определять допустимое TOS для производственных операций (например, наполнение контейнеров, визуальная инспекция, перемещение, приемка, подготовка к доставке);
- выделенные пределы по времени и температуре должны быть установлены для каждого сегмента дистрибьюции (например, первичная и вторичная дистрибьюция);
- для «последней мили» (медицинские учреждения) должны быть установлены конкретные пределы по времени и температуре.
Подробнее о концепции «запаса стабильности» можно прочитать здесь.
Если концепция «запаса стабильности» не применяется, продукция должна храниться и транспортироваться таким образом, чтобы поддерживать установленные температурные пределы. Отказ от мониторинга для продукции, данные о термостабильности которой достаточны для подтверждения отсутствия влияния на ее качество, должен быть основан на риск-ориентированном подходе. Термочувствительная продукция должна храниться в подходящем складском помещении, оборудованном для поддержания установленных температурных пределов. Транспортировка термочувствительной продукции должна осуществляться таким образом, чтобы обеспечить поддержание приемлемого температурного диапазона.
Создание инфраструктуры хранения и логистики с контролируемой температурой
Цель данного этапа — создать инфраструктуру хранения и логистики, необходимую для всех поставляемых продуктов, маршрутов дистрибьюции и рынков. Для этого необходимо следующее:
- оценка и одобрение подрядчиков, оказывающих услуги по дистрибьюции, подразделением обеспечения качества;
- наличие лицензий на дистрибьюцию и назначение лиц, ответственных за соблюдение условий лицензии;
- любые особые требования к хранению или транспортировке, например, для контролируемых лекарственных препаратов или опасных грузов;
- контролируемые по температуре складские помещения в местах отгрузки, назначения и таких местах, как пункты консолидации грузов, включая пункты обработки/сортировки на всем протяжении маршрута, а также при хранении и дистрибьюции на рынке;
- виды транспорта, маршруты дистрибьюции и упаковка, обеспечивающие транспортировку при установленных температурных пределах;
- GxP-соответствующие ИТ-системы, используемые для мониторинга или контроля времени и температуры при хранении термочувствительной продукции;
- cоглашения о качестве.

Одним из ключевых вызовов становится многоэтапность логистической цепочки: груз неоднократно передается от одного оператора к другому, и при этом состояние продукции и упаковки нередко фиксируется недостаточно полно. Такая нехватка прозрачности повышает риск нарушения температурного режима и затрудняет последующий анализ отклонений и инцидентов.
Серьезные трудности создает и недостаточность инфраструктуры для температурных грузов в пунктах перегрузки и перевалки. Условия хранения на терминалах разных стран могут значительно различаться, а действующие нормативные требования и стандарты остаются недостаточно гармонизированными, что усложняет поддержание стабильных параметров холодовой цепи.
При организации перевозок на дальних маршрутах дополнительным фактором риска становятся значительные температурные колебания: на отдельных участках маршрута условия могут изменяться в диапазоне от -20 до +50 °C. В таких обстоятельствах особенно важно тщательно продумать логистическую схему и подобрать решения по упаковке продукции, способные обеспечить стабильный температурный режим на протяжении всей транспортировки.
В мультимодальных перевозках критически важную роль играет экспедитор. Он отвечает за анализ маршрута и выбор оптимального логистического решения с учетом температурного профиля, а также за выявление потенциальных рисков и «узких мест».
Не менее значимой задачей экспедитора является создание единого информационного пространства и установление согласованных правил взаимодействия между всеми участниками перевозки. Это повышает прозрачность процесса, позволяет оперативно обнаруживать отклонения и способствует поддержанию стабильной холодовой цепи даже в самых сложных мультимодальных сценариях.
Проведение оценки рисков при дистрибьюции и согласование плана по снижению рисков
Цель данного этапа — понять потенциальные риски для продукции во время транспортировки с места производства до места назначения с целью подготовки к согласованию соответствующих деталей плана по снижению рисков. Результатом этого процесса является поддержание при транспортировке установленных температурных пределов.
В Памятной записке AiM 07123201 «Проверка пригодности процессов транспортировки» (Inspektion der Eignung von Transportprozessen) [2], подготовленной немецким Центральным ведомством земель по охране здоровья в области лекарственных средств и медицинской продукции (ZLG), приведены примеры таких рисков/сценариев:
- неправильное расположение датчиков температуры или регистраторов данных;
- отказ системы активного охлаждения;
- неправильное расположение хладоэлементов;
- промежуточное хранение в транспортных узлах;
- отсутствие мер противодействия температуре окружающей среды, выходящей за пределы указанной температуры транспортировки;
- превышение установленной максимальной продолжительности транспортировки.
Подробнее об оценке потенциальных рисков, которые могут повлиять на качество перевозимой продукции можно прочитать здесь:
Оценка рисков при дистрибьюции может проводиться для отдельных продуктов или группы продуктов, если есть основания полагать, что они оцениваются как группа, например, связанные определенными условиями хранения или размещения, упаковкой, маршрутом транспортировки или видом транспорта. Риски должны быть оценены и количественно определены. Оценка рисков должна быть одобрена подразделением обеспечения качества, а план по снижению рисков должен быть согласован для конкретного рынка. Для рынков, где регулирующие органы требуют 100%-го мониторинга температуры при всех доставках, необходимо включать это требование в план по снижению рисков и подробно описывать ответственность. В заключении оценки должно быть указано, требуется ли мониторинг температуры или нет. Перед внедрением новых запланированных маршрутов/пунктов назначения необходимо провести обзор соответствующих разделов оценки рисков при дистрибьюции и плана по снижению рисков, чтобы убедиться в целесообразности текущих мер; а также проанализировать данные мониторинга первых поставок после изменения, чтобы выявить любые новые опасности или риски. Если никаких дополнительных рисков не выявлено, применяется существующий план по снижению рисков.

Важно использовать данные, накопленные в ходе уже выполненных перевозок. Анализ фактических маршрутов, отклонений и точек, где чаще всего происходят сбои, помогает определить наиболее уязвимые фрагменты цепи поставок и сфокусировать внимание на тех участках, где требуются усиленные меры контроля. Практическую ценность также дают кейсы профессионального сообщества и опыт транспортных компаний, работающих не только с фармацевтическими грузами, особенно в части специфики планирования маршрутов, сезонных факторов и иных ограничений.
При разработке мер по снижению или удержанию риска также необходимо учитывать характеристики продукции - объем, массу, температурный диапазон хранения, стоимость продукции, а также специальные требования по обращению, при их наличии. В ряде случаев полезно привлекать независимое экспертное мнение для объективной оценки документации, транспортных средств, маршрутов перевозки и распределения ответственности. Такой подход позволяет повысить устойчивость процесса и обеспечить надежность поставок еще на этапе планирования.
В итоге риски полностью не исчезают, но их корректная и своевременная оценка позволяет определить необходимые меры контроля и удерживать эти риски на приемлемом уровне, минимизируя вероятность инцидентов.
Проведение квалификации транспорта и внедрение решений по контролю и мониторингу температуры
Цель данного этапа — реализовать мероприятия по квалификации для хранения, транспортировки и мониторинга. Результатом данной квалификации является создание надежной системы, которая снизит риск влияния на качество и бизнес до того, как меры мониторинга и контроля будут внедрены. Квалификация должна быть проведена для следующих объектов:
- склад (например, склад с контролируемой температурой, холодильная камера, морозильная камера);
- транспортная система (например, транспортные средства с контролируемой температурой, рефрижераторы, изотермическая упаковка и активные системы);
- устройства мониторинга температуры при хранении и дистрибьюции;
- базы данных, используемые для отслеживания серий продукции.
В зависимости от квалифицируемого объекта необходимо подготовить документацию, которая включает квалификацию проекта (DQ), квалификацию монтажа (IQ), квалификацию функционирования (OQ), квалификацию эксплуатации (PQ). Это должно быть официально оформлено в протоколе, а результаты и выводы — в отчете. Если транспортные системы не прошли квалификацию, можно использовать дополнительный мониторинг, если это обосновано.
В Приложении 7 из серии технических докладов ВОЗ №1025 «Надлежащая практика хранения и дистрибьюции лекарственных средств» (Annex 7 to WHO Technical Report Series, No. 1025 — Good Storage and Distribution Practices for Medicinal Products) [3] написано, что область применения и глубина квалификации, а также валидации (где это необходимо) должны определяться с использованием документально оформленных принципов управления рисками. ВОЗ разработала ряд руководящих документов, посвященных этой теме. Список этих документов представлен в Приложении 9 из серии технических докладов ВОЗ №961 «Предисловие к техническим дополнениям» (Annex 9 to WHO Technical Report Series, No. 961 — Introduction to the Technical Supplements) [4].
В Техническом отчете TR 39 «Руководство для лекарственных средств, требующих контроля температуры: Поддержание качества чувствительных к изменению температуры лекарственных средств посредством условий транспортировки» (Guidance for Temperature-Controlled Medicinal Products: Maintaining the Quality of Temperature-Sensitive Medicinal Products through the Transportation Environment) [5], изданном PDA, говорится о том, что принципы квалификации для транспортировки термочувствительных лекарственных средств в точности соответствуют установленным правилам и нормам квалификации для производства этих же продуктов. К ним относятся:
- разработка спецификаций, процессов, систем и компонентов;
- письменные процедуры;
- утвержденные протоколы и отчеты;
- обоснованные методы испытаний и критерии приемлемости;
- квалификационные испытания, проверяющие «ожидаемые экстремальные» условия;
- постоянный мониторинг и/или периодическая оценка;
- контроль изменений.
В том же документе есть следующее примечание о квалификации и валидации применительно к процессам транспортировки:
- «Квалификация — это документально оформленное испытание, которое с высокой степенью уверенности демонстрирует, что конкретный процесс будет соответствовать заранее определенным критериям приемлемости. Валидация — это документально оформленное испытание, проводимое в строго контролируемых условиях, которое демонстрирует, что процесс постоянно приводит к результатам, соответствующим заранее определенным критериям приемлемости. Более того, валидация используется для испытания процессов, методов и систем, условия которых можно контролировать в реальных условиях (т. е. после завершения испытания, когда процесс используется).Таким образом, процессы транспортировки могут быть скорее квалифицированы, чем валидированы, поскольку в реальном мире невозможно контролировать все параметры, которые могут повлиять на процесс транспортировки (например, погодные условия, задержки на таможне и в транспортной системе, технические неисправности и т. д.). Квалифицированный процесс может меняться со временем. Поэтому рекомендуется периодический и надлежащий мониторинг. Частота и тип мониторинга будут зависеть от конкретных условий конкретного процесса дистрибьюции».

В таких случаях мы нередко сталкиваемся с категоричным отказом: «Транспортное средство не может быть допущено к перевозке, так как отсутствует отчет о квалификации именно на этот автомобиль». Заказчик видит лишь конкретную машину и отсутствие сезонных испытаний. Привычный шаблон сломался и посмотреть по сторонам шире в поисках альтернативы особого желания нет.
Между тем, вышеупомянутая Серия технических докладов ВОЗ №961, в частности Дополнение 11 к Приложению 9 «Квалификация рефрижераторных транспортных средств» (Technical Supplement 11 to Annex 9 of WHO Technical Report Series, No. 961 Qualification of Refrigerated Road Vehicles) [6], прямо указывает: «…всегда важно квалифицировать каждое транспортное средство до начала его эксплуатации, когда это возможно… Альтернативный подход заключается в том, чтобы выполнять первоначальную полную квалификацию каждого типа «кузов/холодильно-обогревательная установка» в сочетании с IQ каждого транспортного средства при вводе новых транспортных средств в эксплуатацию». То есть механизм предусмотрен. Он описан ВОЗ и может быть использован.
Почему важно смотреть шире и применять альтернативы там, где это допускают международные рекомендации? Мы живем в условиях, когда поиск, закупка, финансирование и доставка оборудования от привычных мировых поставщиков - это уже не рутинный процесс, а фактически финансовый и организационный подвиг для перевозчика. Чтобы обеспечить надежность перевозок, транспорт необходимо непрерывно обновлять, но сделать это «точь-в-точь» под сезонные тесты практически невозможно. А купить новую технику и не работать на ней в ожидании наступления зимы или лета - непозволительная финансовая роскошь.
Конечно, привычные процессы удобны. Но, как справедливо отмечено в Техническом отчете TR 39 PDA [5], «в реальном мире невозможно контролировать все параметры». Иногда обстоятельства требуют «ехать по объездному пути». Да, может быть дольше, да потребуется больше усилий. Но все эти усилия направлены на одно - чтобы ваши лекарственные препараты, уважаемые производители, доставлялись пациентам с гарантированным качеством, эффективностью и безопасностью, даже в условиях изменений, которые диктует современный мир.
Регистрация температуры во время производства, хранения и дистрибьюции
Цель данного этапа — сохранять и передавать записи о температуре и времени во время приемки, хранения, передачи и дистрибьюции продукции. Производственные подразделения, ответственные за обращение с термочувствительной продукцией, должны регистрировать TOS во время различных видов деятельности и должны гарантировать, что допустимый «предел TOS» не был превышен. Общее TOS, «накопленное» во время производственных операций и хранения должно быть доступно подразделению обеспечения качества до того, как продукт будет выпущен с производственной площадки. Записи о TOS должны быть доступны, чтобы поддерживать прослеживаемость серии при возможных температурных выходах или запросах на переупаковку.
Подробнее о TOS можно прочитать здесь.
Термоиндикаторы или терморегистраторы, необходимые для подтверждения соответствия установленным температурным пределам во время дистрибьюции, необходимо проверять при получении груза. Все записи о дистрибьюции должны быть доступны для отслеживания запасов, что может потребоваться в ходе операции по отзыву. Доступ к записям о дистрибьюции, хранящимся у третьих сторон, должен быть определен в соглашениях о качестве.

- выявить проблемное звено в логистической цепочке (неисправный холодильник, ошибки при погрузке);
- предотвратить потери, вовремя отозвав партию, на которую повлияло температурное отклонение;
- принять обоснованное решение о дальнейшей судьбе лекарственного препарата.
В соответствии с требованиями «Правил надлежащей дистрибьюторской практики в рамках Евразийского экономического союза», утвержденных Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. №80 [7], поставщик по запросу получателя обязан предоставить данные, подтверждающие соблюдение температурного режима при хранении и транспортировке термолабильных лекарственных средств. Система непрерывного мониторинга создает цифровой след (отчет), который доступен всем участникам цепи.
Для обеспечения выполнения предъявляемых требований по контролю температуры используются:
- Термоиндикаторы - простой, но не всегда достаточно точный метод.
- Терморегистраторы - автономные устройства, которые записывают температуру через заданные промежутки времени. Позволяют проанализировать всю историю перевозки/хранения.
- Системы удаленного мониторинга в реальном времени - самые современные решения. Они передают данные через GSM или спутниковую связь, позволяя отслеживать температуру и получать информацию об отклонениях непосредственно во время транспортировки.
Эпизодические проверки с фиксацией записей вручную бесполезны: они фиксируют температуру только в момент проверки, но не могут зафиксировать скачки температуры; показать, что произошло с грузом во время погрузки и разгрузки в аэропорту; доказать, что отклонение было кратковременным и не повлияло на качество.
Управление температурными выходами во время производства, хранения и дистрибьюции
Температурный выход (temperature excursion) — это событие/инцидент, при котором термочувствительное лекарственное средство подвергается воздействию температур, выходящих за пределы диапазона, установленного для хранения и/или транспортировки.
Цель данного этапа — управлять температурными выходами на различных этапах производства/цепочки поставок, в том числе:
- до наполнения контейнеров (возможные причины: перемещение заняло больше времени, чем максимально допустимое; неисправность холодильной камеры);
- во время наполнения контейнеров, упаковки, подготовки к доставке (возможные причины: «накопленное» во время операций ТОS превышает предел; неисправность холодильной камеры; неправильное размещение паллет с продукцией);
- при дистрибьюции (возможные причины: неожиданные задержки; экстремальные условия, продукт не хранился в предписанных условиях).
Каждое производственное подразделение должно внедрить систему, гарантирующую, что в случае превышения «предела TOS», установленного в рамках операционной деятельности, об инциденте будет немедленно сообщено ответственным лицам площадки для оценки и проведения расследования. Аналогичная система должна быть внедрена в подразделении логистики. Затронутая продукция должна быть перемещена в режим ограниченного использования/карантина (в электронном и/или физическом виде) с проведением оценки ее дальнейшей судьбы. Необходимо выявить корневую причину температурного выхода, выполнить корректирующие и предупреждающие действия (CAPA). Следует принять дополнительные меры для предотвращения повторных температурных выходов, например, более надежную теплозащиту, использование другого перевозчика, отправку в другое время и/или день недели. При проведении расследования необходимо также учитывать виды транспорта и перевозчиков, места отгрузки и назначения, теплозащиту, используемую во время доставки (пассивная/активная), конфигурацию груза, температуру окружающей среды, место возникновения температурного выхода (например, в прицепе, на таможне, на борту воздушного судна). Для оценки потенциального воздействия на продукт может потребоваться проведение дополнительных испытаний, например, аналитических или имитационных. В случае температурных выходов данные о термостабильности продукции могут быть использованы для принятия решений о ее дальнейшей судьбе. При проведении оценки пригодности продукта к использованию следует принимать во внимание следующее:
- оценка информации о времени выхода и температуре в сравнении с данными о термостабильности конкретного продукта;
- точность регистраторов данных для особо чувствительных продуктов;
- физические повреждения;
- фактические температурные условия во время транспортировки, размещения или хранения;
- расчеты средней кинетической температуры — для рынков, где регулирующие органы принимают такие обоснования.
Средняя кинетическая температура, СКТ (Mean Kinetic Temperature, MKT) — это единая расчетная температура, при которой общая степень деградации за определенный период времени равна сумме степеней деградации при различных температурах [8, 9].
В Руководстве ICH Q1A(R2) «Исследования стабильности новых лекарственных веществ и препаратов» (Stability Testing of New Drug Substances and Products) [8], СКТ определена как единая расчетная температура, которая при поддержании в течение определенного периода времени оказывает такое же тепловое воздействие на лекарственное вещество или лекарственный препарат, которое возникало бы в диапазоне более высоких и более низких температур в течение эквивалентного заданного периода. СКТ выше средней арифметической температуры и рассчитывается с учетом уравнения Аррениуса.
Проще говоря, СКТ — это расчетная температура, которая оказывает такое же влияние на стабильность продукта, как и фактический, флуктуирующий температурный профиль. При расчете более высокие температуры имеют больший вес, чем более низкие, в соответствии с уравнением Аррениуса, которое гласит, что химические реакции экспоненциально ускоряются с ростом температуры [10].
Среди проектов одобренных фармакопейных статей 4 части I тома Фармакопеи ЕАЭС размещен проект ОФС «Оценка кратковременных температурных колебаний при хранении и транспортировке лекарственных препаратов» [9]. Текст этого документа во многом совпадает с текстом главы <1079.2> «Средняя кинетическая температура в оценке температурных выходов при хранении и транспортировке лекарственных препаратов» (Mean Kinetic Temperature in the Evaluation of Temperature Excursions During Storage and Transportation of Drug Products) [11] Фармакопеи США (USP). Не случайно самые важные выводы приведены в заключении главы <1079.2>:
- «Несмотря на то, что необходимо прилагать все усилия для хранения и дистрибьюции лекарственных препаратов в указанном на маркировке диапазоне, температурные выходы могут иметь место. Использование СКТ для оценки кратковременного выхода (как определено в главе <659>) и временного периода, используемого для расчета СКТ, рекомендованного USP, позволит ответственно управлять температурными выходами. Важно отметить, что выходы за допустимые пределы, установленные USP, должны оцениваться производителем, поскольку указание температур и времени отклонения имеет решающее значение для определения дальнейшей судьбы продукта. СКТ не может использоваться для оправдания системы хранения или транспортировки, допускающей неоднократные температурные выходы; такая система не находится под контролем и требует корректировки».
При этом в статье «Средняя кинетическая температура (СКТ): расчет, преимущества и ограничения» (Mean Kinetic Temperature (MKT): Calculation, Benefits, and Limitations) [10] говорится о том, что несмотря на свою практическую полезность, СKT не заменяет обязательство соблюдать установленные температуры хранения и транспортировки — ни с точки зрения регулирования, ни с точки зрения качества.
Еще в 2015 году немецкая Экспертная группа 10 «Оптовая торговля/Фармацевтическая дистрибьюция» подготовила документ «Вопросы и ответы по ведению оптового фармацевтического бизнеса» (Frage- und Antwortpapier zum Betreiben eines Großhandels mit Arzneimitteln) [12], в котором есть следующий ответ на вопрос «Можно ли использовать СКТ как часть подхода, основанного на оценке риска, для оценки выходов температуры во время транспортировки?»:
- «СKT не учитывает эффекты, которые могут привести к необратимым дефектам качества даже при кратковременном превышении определенных температурных пределов, установленных в ходе исследований стабильности в рамках процесса регистрации. Возможное образование трещин в стеклянных ампулах или флаконах для инъекций при температурах, близких к точке замерзания, также не учитывается. Кроме того, для расчета СKT необходимо знать полную историю температур на всех предыдущих этапах транспортировки. Однако эти данные обычно недоступны, поэтому содержательный расчет выполнить невозможно. Решающее значение имеет соблюдение установленных температур хранения или транспортировки».
Стоит отметить, что спустя почти 10 лет после публикации вышеупомянутого документа эксперты Рабочей группы 09 «Квалификация/валидация» — авторы Памятной записки AiM 07123201 — по-прежнему считают необходимым отметить, что СКТ до сих пор не является общепринятой мерой оценки рисков, связанных с температурными выходами во время транспортировки [2, 10].
В документе GUI-0069 «Руководство по контролю воздействия окружающей среды при хранении и транспортировке лекарственных средств» (Guidelines for environmental control of drugs during storage and transportation) [13], подготовленном Министерством здравоохранения Канады, говориться о том, что использование СКТ для мониторинга допускается только в соответствии с требованиями признанной фармакопеи. Должна быть разработана процедура, определяющая целесообразность использования СКТ, и методология определения необходимых расчетов. В том же документе есть следующее примечание:
«Использование СКТ может быть нецелесообразным в следующих случаях:
- жидкости или суспензии подвержены фазовым переходам;
- продукты требуют охлаждения или заморозки;
- продукты являются биологическими;
- данные могут указывать на то, что температурные выходы влияют на качество продукта».
В любом случае, СКТ может быть полезным дополнительным инструментом в рамках подхода к управлению температурой, основанного на оценке рисков, особенно для интерпретации данных регистратора температуры во время транспортировки [10].

Предварительное обсуждение общей фармакопейной статьи ЕАЭС «Оценка кратковременных температурных колебаний при хранении и транспортировке лекарственных препаратов» [8] проводилось с марта по май 2025 года. В этом проекте ОФС центральное значение было уделено именно СКТ. Но несмотря на то, что в предисловии проекта ОФС отмечалось о научно-обоснованном подходе к применению СКТ для оправдания температурных колебаний, думаю, что такого обзора научных статей, монографий по этому вопросу, не было произведено.
Единственная работа, которая мне встречалась по положительной оценке использования СКТ при обосновании температурных колебаний, это работа американских ученых «Использование средней кинетической температуры (СКТ) при обработке, хранении и дистрибьюции термочувствительных фармацевтических препаратов» (The Use of Mean Kinetic Temperature (MKT) in the Handling, Storage, and Distribution of Temperature Sensitive Pharmaceuticals) [14], опубликованная в 2009 году в Pharmaceutical Outsourcing. Но предложенный в этой работе способ не позволяет однозначно судить о качестве лекарственного препарата. Замечания и ошибки, допущенные в работе, представлены здесь.
Большое количество научных работ, в том числе приведенных в этом материале, свидетельствуют о том, что применение СКТ для обоснования кратковременных отклонений на сегодняшний день преждевременно и требует тщательного изучения, прежде всего - производителями и разработчиками лекарственных средств.
Выполнение периодического обзора систем контроля температуры и процесса
Цель данного этапа — управлять любыми изменениями в дистрибьюции с контролируемой температурой. Необходимо проводить ежегодный обзор температурных выходов и отклонений, связанных с управлением холодовой цепью. Обзор должен включать оценку следующих факторов:
- надежность этапов производства и мероприятий, связанных с управлением холодовой цепью;
- эффективность конфигурации упаковки в холодовой цепи;
- тенденции транспортировки/дистрибьюции, связанные с воздействием на продукт температурного профиля, репрезентативного для профиля квалификации.
Обзор оценки рисков при дистрибьюции также должен проводиться на ежегодной основе.

Для логистики холодовой цепи искусственный интеллект (ИИ) должен быть не просто «предсказателем», а цифровым иммунитетом системы.
Ключевые риски холодовой цепи и отвечающие за них ИИ:
Прогнозные модели и Анализ временных рядов - для предсказания температурных нарушений.
Компьютерное зрение - для контроля целостности и процедур.
ИИ-платформы для мониторинга холодовой цепи «под ключ».
Крупные языковые модели (LLM) - для анализа регламентов и проактивного планирования.
Рекомендательные системы и оптимизация.
Практический план внедрения:
Инструментарий - начните с пилотного проекта на основе SaaS-платформы для мониторинга холодовой цепи (Controlant, Tive) - это даст быстрый результат без сложной разработки.
Данные - оборудуйте паллеты или коробки IoT-датчиками, передающими данные о температуре, влажности, ударах и геолокации в реальном времени, это - «пища» для ИИ.
Аналитика - подключите облачную ML-платформу (Google Vertex AI) к этим данным, чтобы строить первые прогнозные модели температурных выходов.
Принятие решений - используйте LLM (ChatGPT/Claude через API), чтобы помочь менеджерам анализировать инциденты, генерировать отчеты и проверять соответствие нормам.
Выводы и рекомендации:
- Для логистики холодовой цепи лучший ИИ - это комбинация IoT-платформ с готовым ИИ для мониторинга и прогнозных ML-моделей на облачных платформах для глубокого анализа;
- LLM (генеративные ИИ) выступают как мощный усилитель для работы с информацией и регламентами;
- Цель - сместить фокус с реагирования на инциденты на их предсказание и предотвращение.
Управление температурой во время производства, хранения и дистрибьюции играет важнейшую роль в сохранении качества, эффективности и безопасности термочувствительных лекарственных средств. Снизить риск негативного воздействия температур, выходящих за пределы указанных условий хранения и транспортировки, позволяет надлежащая реализация концепции холодовой цепи.
Представленный материал подготовлен с использованием данных, актуальных на 30.11.2025 г. В случае получения новых или дополнительных данных статья может быть обновлена.
Ссылки:
- PDA / PDA Technical Report No. 53 (TR 53) Guidance for Industry: Stability Testing to Support Distribution of New Drug Products (single user digital version). URL: https://www.pda.org/bookstore/product-detail/1201-tr-53-guidance-for-industry-stability-testing (дата обращения 30.11.2025)
- ZLG / Inspektion der Eignung von Transportprozessen. URL: https://www.zlg.de/index.php?eID=dumpFile&t=f&f=8719&token=247e660bec064575a48745d4dcbf452e1f3bbff3 (дата обращения 30.11.2025)
- WHO / TRS 1025 — Annex 7: Good storage and distribution practices for medical products. URL: https://cdn.who.int/media/docs/default-source/medicines/norms-and-standards/guidelines/distribution/trs1025-annex7-(1).pdf?sfvrsn=1f96888d_4&download=true (дата обращения 30.11.2025)
- WHO / TRS 961 — Annex 9: Introduction to the Technical Supplements. URL: https://cdn.who.int/media/docs/default-source/medicines/norms-and-standards/guidelines/distribution/trs961-annex9introduction.pdf?sfvrsn=64f4568_2&download=true (дата обращения 30.11.2025)
- PDA / PDA Technical Report No. 39 (TR 39) Revised 2007 Guidance for Temperature-Controlled Medicinal Products: Maintaining the Quality of Temperature-Sensitive Medicinal Products through the Transportation Environment (дата обращения 30.11.2025)
- WHO / Technical supplement 11 to WHO Technical Report Series, No. 961 Qualification of refrigerated road vehicles. URL: https://www.who.int/publications/m/item/Annex-9-j-trs-961 (дата обращения 30.11.2025)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 80 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза». URL: https://docs.eaeunion.org/docs/ru-ru/01411930/cncd_21112016_80 (дата обращения 30.11.2025)
- EMA / ICH Topic Q1A (R2) Stability Testing of new Drug Substances and Products. URL: https://www.ema.europa.eu/en/documents/scientific-guideline/ich-q-1-r2-stability-testing-new-drug-substances-and-products-step-5_en.pdf (дата обращения 30.11.2025)
- ЕЭК / Коллегия ЕЭК / Проекты одобренных фармакопейных статей ФС / Предварительное обсуждение ФС. ОФС «Оценка кратковременных температурных колебаний при хранении и транспортировке лекарственных препаратов». URL: https://eec.eaeunion.org/upload/files/deptexreg/LSMI/ОФС%20Оценка%20ТК%20при%20хранении%20и%20транспортировке%20ЛП-1.pdf?ysclid=mh0xpgre92829919578 (дата обращения 30.11.2025)
- ECA Academy / Mean Kinetic Temperature (MKT): Calculation, Benefits, and Limitations. URL: https://www.gmp-compliance.org/gmp-news/mean-kinetic-temperature-mkt-calculation-benefits-and-limitations (дата обращения 30.11.2025)
- USP / USP General Chapter <1079.2> Mean Kinetic Temperature in the Evaluation of Temperature Excursions During Storage and Transportation of Drug Products URL: https://www.usp.org/sites/default/files/usp/document/supply-chain/apec-toolkit/USP%20GC1079.2.pdf (дата обращения 30.11.2025)
- ZLG / Frage- und Antwortpapier zum Betreiben eines Großhandels mit Arzneimitteln. URL: https://www.zlg.de/index.php?eID=dumpFile&t=f&f=1258&token=11baef53d114160442f847a78cde7576d77ffc99(дата обращения 30.11.2025)
- Health Canada / GUI-0069 Guidelines for Temperature Control of Drug Products during Storage and Transportation. URL: https://www.canada.ca/content/dam/hc-sc/migration/hc-sc/dhp-mps/alt_formats/pdf/compli-conform/gmp-bpf/docs/GUI-0069_V3_EN_Aug%2010.pdf (дата обращения 30.11.2025)
- The use of mean kinetic temperature (MKT) in the handling, storage, and distribution of temperature sensitive pharmaceuticals. Robert H. Seevers, Ph.D., Rafik H. Bishara, Ph.D., Paul Harber, Dave Ulrich, Jeffrey Hofer Pharmaceutical Outsourcing May | June 2009 (дата обращения 30.11.2025)
- Pharmtech & Ingredients / Итоги первого дня работы выставки Pharmtech & Ingredients 2025. URL: https://pharmtech-expo.ru/ru/media/news/2025/november/25/pharmtech-2025-itogi-pervogo-dnya/ (дата обращения 30.11.2025)

