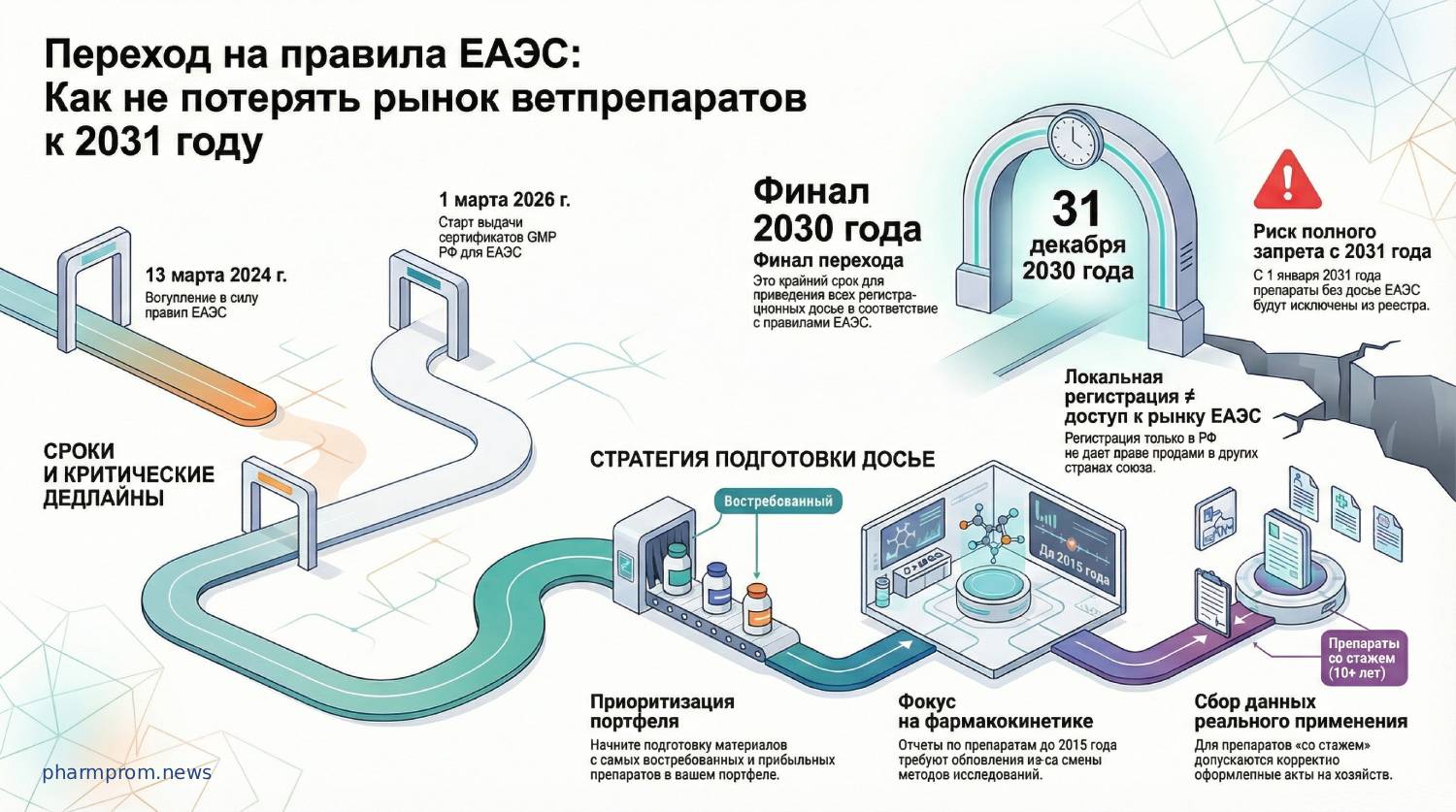
С марта 2024 года в Евразийском экономическом союзе (ЕАЭС) официально действуют наднациональные правила обращения ветеринарных препаратов. Несмотря на то что процесс запущен, рынок только начинает осознавать масштаб предстоящей работы. О том, почему сроки перехода планируют продлить до 2030 года и какие сложности возникают при подготовке досье, рассказала заместитель начальника Управления государственного ветеринарного надзора Россельхознадзора Анна Бабушкина.
Решение о продлении: 2030 год как «крайняя точка»
Изначально установленный дедлайн (2027 год) оказался под угрозой из-за медленной подготовки рынка и неготовности административной инфраструктуры в ряде стран. Сейчас на рассмотрении находится третий пакет поправок к правилам ЕАЭС, предполагающий продление переходного периода до 31 декабря 2030 года.
Как отметила Анна Бабушкина в интервью изданию «Ветеринария и жизнь», инициатором переноса сроков выступила Белоруссия, предложение поддержал Казахстан. В этих странах пока не выстроены системы пошлин, взаиморасчетов и платежей. Продление даст бизнесу дополнительное время, но регулятор подчеркивает необратимость последствий при несоблюдении сроков.
«Если переходный период завершится 31 декабря 2030 года, то с 1 января 2031 года такие препараты не будут включены в единый реестр и не смогут обращаться ни в одной из стран союза. Речь идет о полном прекращении обращения на пространстве ЕАЭС».
— Анна Бабушкина, замначальника Управления госветнадзора Россельхознадзора
Фармакокинетика и «старые» досье
Наибольшую сложность при формировании досье вызывают данные по фармакокинетике. Для лекарств, зарегистрированных до 2015 года, старые отчеты признаны неактуальными, так как методы исследований того времени уже не соответствуют современным стандартам. Это касается фармакотерапевтических препаратов, антибиотиков и кокцидиостатиков — по ним необходимо готовить новые отчеты.
Для препаратов, которые обращаются на рынке РФ более 10 лет, предусмотрено послабление: вместо новых тестов на эффективность допускается предоставление должным образом оформленных отчетов и актов о применении в хозяйствах, а также актуального пятилетнего отчета по фармаконадзору.
Статус новых препаратов и платежи
Важный нюанс касается продуктов, вышедших на рынок после 13 марта 2024 года. На текущем этапе единый рынок для них еще не функционирует в полной мере.
«Новые препараты пока могут обращаться только в стране, где они зарегистрированы. То есть регистрация в России не дает автоматически право продажи в Казахстане, Белоруссии или других странах союза. Это принципиальный момент, который бизнесу важно учитывать при выводе новых продуктов на рынок».
— Анна Бабушкина, замначальника Управления госветнадзора Россельхознадзора
Что касается пошлин, Россельхознадзор уже разместил реквизиты для РФ на своем сайте. Данные по остальным странам союза будут аккумулированы на ресурсах Евразийской экономической комиссии (ЕЭК).
Вердикт регулятора
Бизнесу рекомендуется уже сейчас проанализировать свой портфель и выделить наиболее востребованные препараты для приоритетного проведения исследований и подачи материалов. Регулятор призывает не откладывать работу на конец 2030 года и избегать попыток подать все досье одновременно.
«У регулятора и экспертных организаций ограничены человеческие и временные ресурсы. Мы рассчитываем на равномерную подачу материалов, чтобы процесс проходил без перегрузок и сбоев».
— Анна Бабушкина, замначальника Управления госветнадзора Россельхознадзора