Масштаб и устойчивость: «Эффект насыщения»
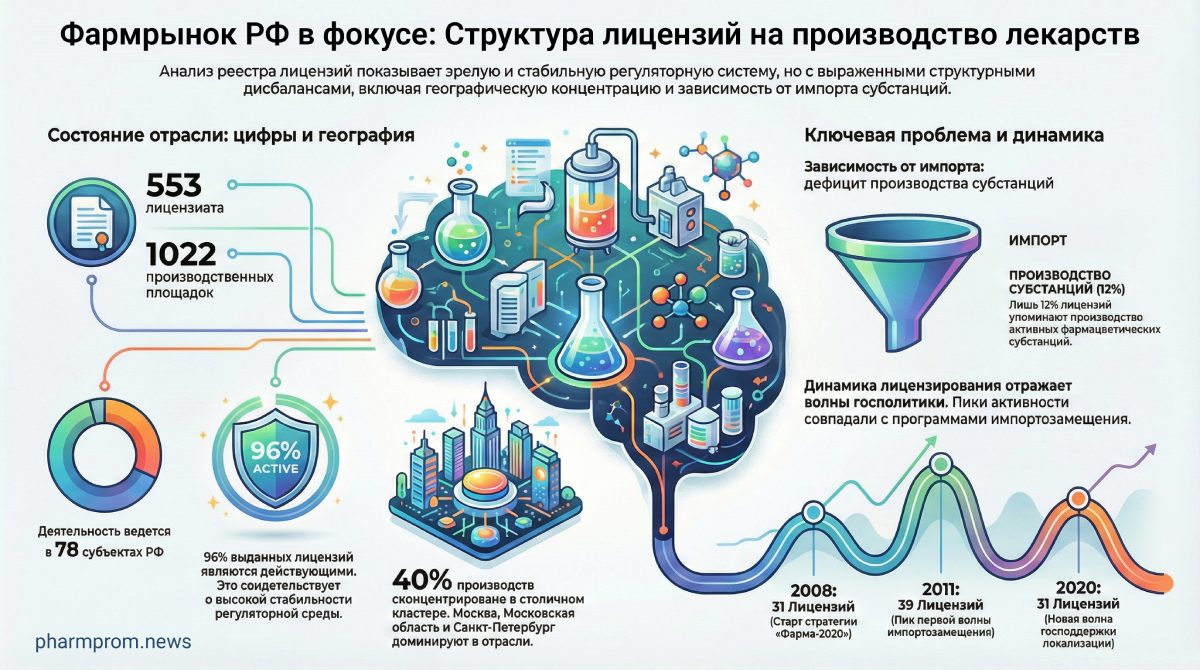
По официальным данным на 13 января 2026 года, в Российской Федерации действовует 553 лицензиата, управляющих 1022 производственными площадками в 78 субъектах страны.
Детальный анализ выборки лицензий подтверждает высокую надежность сектора: 96% документов (501 шт.) имеют статус «Действующая». Доля приостановленных лицензий составляет всего 4%, причем в большинстве случаев речь идет о временной приостановке для устранения нарушений или переоформления, что свидетельствует о функционирующей системе контроля.
Динамика выдачи лицензий отражает ключевые этапы развития отрасли:
- Пик инвестиций (2011 г.): Выдано 39 лицензий на старте программы «Фарма-2020».
- Ответ на вызовы (2020 г.): Всплеск до 31 лицензии на фоне пандемии.
- Стабилизация (2023–2025 гг.): Показатель закрепился на уровне 15–22 лицензий в год.
Эксперты характеризуют текущий этап как «эффект насыщения»: рынок заполнен игроками, и фокус сместился с открытия новых юрлиц на модернизацию и расширение компетенций существующих заводов.
География: Баланс между центром и регионами
Отрасль сохраняет исторически сложившуюся концентрацию в «столичном кластере». Москва, Московская область и Санкт-Петербург суммарно удерживают около 40% всех производственных лицензий:
- Москва — 23% (120 лицензий);
- Московская область — 10% (53 лицензии);
- Санкт-Петербург — 7% (37 лицензий).
Тем не менее, по данным Минпромторга наличие площадок в 78 субъектах РФ подтверждает глубокое проникновение индустрии в регионы. В стране сформировались производственные центры во Владимирской, Калужской, Новосибирской, Свердловской областях, что снижает риски логистической централизации.
Структура видов деятельности
Анализ содержания лицензий выявляет типичную модель работы российского фармпроизводителя. Стандартный «лицензионный пакет» включает три ключевых элемента, упоминаемых с одинаковой частотой (~90 раз в выборке): производство, хранение и реализация, что указывает на структуру лицензии как комплексного документа, охватывающего цикл от производства до дистрибуции.
Такая интеграция создаёт эффект масштаба для крупных фармацевтических компаний и позволяет вертикально интегрированным производителям контролировать весь спектр деятельности. Однако это также может привести к разбавлению фокуса — компания может быть лицензирована на производство, но на деле заниматься в основном реализацией готовых препаратов.
Особое место в структуре занимает производство фармацевтических субстанций. На данный вид деятельности приходится около 12% упоминаний в реестре. Это свидетельствует о том, что подавляющее большинство лицензированных производств занимаются вторичной переработкой — получением ГЛФ из готовых или полусырьевых компонентов, которые импортируются или получаются из иных источников, в то время как синтез активных веществ остается нишей для специализированных площадок. Тем не менее, государственные программы импортозамещения нацелены на постепенное увеличение этой доли в будущем.
Главные выводы
Реестр лицензий образца 2026 года отражает зрелую, но неполную фармацевтическую экосистему. С одной стороны, высокая доля действующих лицензий указывает на надежность регуляторной системы и адаптацию производителей к жестким стандартам. С другой — мы видим структурные перекосы:
- Географическая концентрация в столичном кластере;
- Острый дефицит производства активных фармацевтических субстанций;
- Снижение темпов лицензирования.
Государственная политика импортозамещения, запущенная еще в 2008 году, обеспечила базу, но для достижения реального фармацевтического суверенитета необходим переход от «упаковки» к синтезу. Вызовы, стоящие перед отраслью, требуют синхронизации усилий государства и бизнеса именно в сегменте глубокой переработки.
Все эти данные доступны для самостоятельного анализа в нашем новом сервисе — Единый реестр производителей лекарственных средств.
Проверьте лицензию на производство лекарственных средств
Полный перечень лицензиатов с детализацией по видам работ доступен в нашем реестре

