
Специалист по GMP, аудитор фармацевтических предприятий
Документация составляет неотъемлемую часть системы обеспечения качества и является ключевым элементом работы в соответствии с Надлежащей производственной практикой (Good Manufacturing Practice, GMP).
Пробелы в ведении документации и проблемы с целостностью данных относятся к числу распространенных несоответствий требованиям GMP. Как пример, нарушения, связанные с Главой 4 «Документация», занимают второе место в отчете MHRA за 2019 год по наиболее часто выявляемым во время GMP-инспекций недостаткам [1].
Эта статья посвящена обзору новой версии Главы 4 в Руководстве Европейского Союза по GMP (EU GMP) [2].
«Усы, лапы и хвост — вот мои документы!»
«На документах всегда печать бывает. Есть у вас печать на хвосте?»
(из мультфильма «Каникулы в Простоквашино»)
Введение
Документация является основой подотчетности, прослеживаемости и согласованности в регулируемых средах. В ходе инспекций регулирующие органы часто начинают с ключевых документов для оценки:
- надежности системы управления качеством;
- четкого определения ролей и обязанностей;
- доказательств непрерывного совершенствования и соответствия требованиям;
- прослеживаемости материалов, процессов и данных.
Неполная, устаревшая или плохо структурированная документация может быстро привести к серьезным замечаниям в ходе проверки [3].
Проект новой версии Главы 4 EU GMP был опубликован в июле прошлого года. Рабочая группа инспекторов GMP/GDP и Комитет PIC/S совместно рекомендовали пересмотреть текущую версию Главы 4, посвященной документации [4], с учетом изменений в нормативно-правовой и производственной среде. Пересмотренное руководство уточняет требования и ожидания регулирующих органов в отношении документации и учитывает соответствующие изменения в Приложении 11 к EU GMP [5].
В пересмотренной Главе 4 внесены изменения, подчеркивающие важность документации для соблюдения требований GMP и поддерживающие использование новых технологий, гибридных решений и новых услуг в управлении документацией. Принципы управления рисками теперь занимают центральное место и интегрированы в систему управления данными для обеспечения точности, целостности, доступности и разборчивости документов во всех форматах — бумажном, цифровом или гибридном. Вся документация, будь то текстовая, графическая, в видео или аудио форме, должна оставаться полной и удобочитаемой на протяжении всего своего жизненного цикла.
Руководство также уточняет требования к управлению электронными записями, подписями и целостностью данных, обеспечивая при этом согласованность с одновременным пересмотром Приложения 11 [6].
Основные различия между действующей версией и проектом новой версии
Основные различия между разделами действующей версии Главы 4 EU GMP и прошлогодним проектом были представлены в табличной форме в статье «Обновленные проекты EU GMP в 2025 году: Глава 4, Приложение 11 и Приложение 22 — Что меняется?» (2025 EU GMP Draft Updates: Chapter 4, Annex 11, and Annex 22 — What’s Changing?) [7] на портале GMP Insiders.
| Раздел | Версия 2011 | Проект 2025 | Тип изменения |
Значение / Примечания |
|---|---|---|---|---|
| Принцип | Документация может существовать в бумажном, электронном или фото-формате. Особое внимание уделено контролю и регистрации всех действий, влияющих на качество. | Особое внимание уделено жизненному циклу данных, метаданным, ALCOA++, гибридным системам и взаимосвязи с системой управления качеством. Управление данными теперь является обязательным требованием. | Существенно обновленная и расширенная версия | Соответствует современным цифровым стандартам и Приложению 11. Более строгие нормативные требования к целостности данных. |
| Документация, требуемая GMP | Описаны основные типы: досье производственной площадки, спецификации, СОП, протоколы, отчеты и т. д. | Уточнены типы документов: инструкции, записи, сертификаты. Введено понятие владения метаданными и ответственности за них. | Расширенная и перефразированная версия | Более точно отражает сложность обработки данных и современные интерпретации нормативных требований. |
| Создание и контроль | Базовый контроль документов, включая гибридные формы, оригиналы и копии. | Добавлены управление шаблонами, роли доступа, валидация системы и цифровые контрольные следы. Четко определены ожидания для гибридной системы. | Расширенная версия | Обеспечивает прослеживаемость и согласованность в смешанной/электронной средах. |
| Надлежащая практика ведения документации | Рукописные записи должны быть сделаны так, чтобы внесенные данные нельзя было удалить, они должны быть разборчивыми и сделаны в режиме реального времени. Исправления не должны закрывать оригиналы. | Введены ALCOA++, одновременная запись данных, защищенные контрольные следы, элементы управления метаданными и роли доступа пользователей. | Существенно расширенная версия | Усиливает ввод данных в режиме реального времени, прослеживаемость и возможность аудита, особенно в электронных системах. |
| Хранение документов | Минимальный срок хранения согласно окончанию срока годности продукта. Устаревшие документы подлежат удалению. | Добавлены долговременная читаемость, сохранение цифровых записей, а также проверка гибридной системы. | Расширенная и уточненная версия | Обеспечивает поддержку цифровой документации и готовность к инспекциям в течение длительного времени. |
| Утверждение и контроль документов | Утверждение авторизованным лицом, с указанием даты, контролируемые версии. | Добавлены процедуры контроля версий, валидация шаблонов, цифровые подписи и контрольные следы для изменений. | Расширенная и ориентированная на цифровые технологии версия | Обеспечивает соответствие нормативным требованиям в системах электронного документооборота и централизованного контроля. |
| Использование документов | Документы должны быть доступны и удобочитаемые в рабочих зонах. | Закреплено использование действующих версий. Добавлен контроль доступа по ролям пользователей для электронных систем. | Расширенная версия | Помогает предотвратить ошибки, вызванные устаревшими или несанкционированными инструкциями. |
| Документирование деятельности | Действия должны фиксироваться в режиме реального времени, а корректировки должны быть обоснованы. | Требуется наличие контрольных следов, причины изменений, надежного хранения метаданных и системного контроля. | Существенно расширенная версия | Крайне важно для обеспечения соответствия цифровым требованиям и последовательного выполнения действий. |
| Обращение с гибридными системами и метаданными | Не рассматривалось. | Полностью определено. Требуется контроль над гибридными системами, владением метаданными, их хранением и интеграцией с ФСК. | Новый раздел | Заполняет пробел в распространенных современных системах (например, комбинация бумажных документов и LIMS). Имеет высокую нормативно-правовую значимость. |
| Глоссарий | Нет | Определены ALCOA++, метаданные, исходные данные и т. д. | Новый раздел | Обеспечивает единообразную интерпретацию документов в рамках EU GMP и инспектирования. |
Основные нововведения в новой версии
Принцип
В связи с переориентацией Главы на технологии и риски, в настоящее время принципы рассматривают применение требований как к бумажным, так и к электронным документам [8].
Для обеспечения того, чтобы фармацевтическая система качества включала достаточно подробные инструкции, должны применяться принципы управления рисками для качества. Это должно способствовать общему пониманию требований. Помимо обеспечения регистрации различных процессов и риск-ориентированной оценки любых отклонений, это должно демонстрировать постоянное применение всех требований (п. 4.5.).
В п. 4.7. проекта новой версии Главы 4 уточняется, что документация может существовать и в таких формах, как изображения, видео- и аудиозаписи. Независимо от того, создаются, хранятся и управляются ли документы в электронном виде, на бумаге, другими способами или с помощью гибридной системы, они должны соответствовать одним и тем же требованиям GMP в отношении разборчивости, точности, целостности и полноты на протяжении всего жизненного цикла. Это также относится к случаям, когда документация передается на аутсорсинг (п. 4.8.).
Системы управления данными
В этом совершенно новом разделе признается необходимость определения процессов управления данными, обеспечивающих надлежащий контроль на основе рисков [8].
Здесь говорится о том, что независимо от способа создания, обработки, хранения и управления документами (т. е. с использованием электронных, бумажных или гибридных систем), GMP-регулируемый пользователь должен создать систему управления данными, являющуюся неотъемлемой частью фармацевтической системы качества, для определения, приоритизации и информирования о мероприятиях по управлению рисками, связанными с целостностью данных. В разделе описан жизненный цикл данных, требования о том, что системы управления данными должны опираться на подход управления рисками, на чем они должны основываться и что они должны учитывать (п. 4.10 — п. 4.18).
В опубликованной на портале GMP Insiders статье «Целостность данных и управление данными GMP» (Data Integrity and Data Governance in GMP) [9] было написано, что внедрение системы управления данными не является юридически обязательным, но помогает организациям эффективно управлять рисками, связанными с целостностью данных. Без этого усилия по обеспечению целостности данных могут быть разрозненными, что может привести к пробелам в контроле. Здесь же представлены основные элементы системы: интеграция и владение, дизайн и ресурсы, меры контроля, обязательства руководства, документация и обзор.
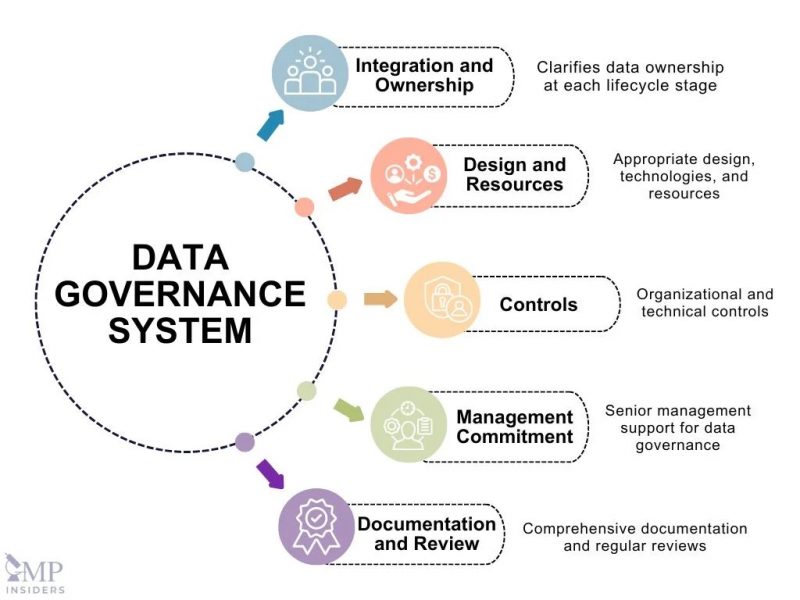
Управление рисками
Теперь, выделенное в отдельный раздел, управление рисками занимает центральное место при определении процессов и мер контроля, необходимых для документирования и управления записями на протяжении всего жизненного цикла данных [8].
В этом разделе прослеживается связь Главы 4 с Руководством ICH Q9 [10]. Здесь изложено требование о применении GMP-регулируемым пользователем риск-ориентированного подхода к документации на протяжении всего жизненного цикла данных, говорится о необходимости обоснования глубины мероприятий по управлению данными и рисками (которая должна быть соизмерима с рисками для качества продукции и безопасности пациентов) и на чем должны основываться решения о масштабе мер по обеспечению целостности данных (п. 4.19 — п. 4.21).
В п. 4.22 есть ссылка на требования к квалификации или валидации соответствующих компьютеризированных систем независимо от процессов, используемых для генерации электронных данных, в соответствии с Приложением 11 к EU GMP, которое сейчас также пересматривается. Это пересмотренное Приложение будет устанавливать более строгие требования к управлению жизненным циклом компьютеризированных систем, предписывая всестороннее применение принципов управления рисками для качества на всех этапах [6]. Среди прочего, обновленные положения Приложения 11 будут усиливать меры контроля, связанные с обеспечением целостности данных, контрольных следов, электронных подписей и безопасности системы.
Общие требования к документации
В этом новом разделе рассматриваются вопросы управления жизненным циклом, применение Приложения 11 и необходимость обеспечения целостности данных [8].
Фармацевтическая система качества должна описывать все документы, необходимые для обеспечения качества продукции и безопасности пациентов. Использование электронных, бумажных или других средств, гибридных решений или хостинг-сервисов для ведения и хранения документации требует соблюдения всех положений EU GMP, включая Приложение 11 (п. 4.23).
В п. 4.23 — п. 4.25. есть ссылки на использование искусственного интеллекта. В частности, ответственность за целостность документов, записей или (исходных) данных, созданных или обработанных с помощью искусственного интеллекта или любых других автоматических средств (например, валидационных скриптов), лежит на GMP-регулируемом пользователе.
Новое Приложение 22 к EU GMP [11] будет применяться ко всем типам компьютеризированных систем, используемых в производстве лекарственных средств и АФС, где модели искусственного интеллекта применяются в критически важных приложениях, оказывающих непосредственное влияние на безопасность пациентов, качество продукции или целостность данных, например, для прогнозирования или классификации данных. Для обеспечения целостности данных, данные, записанные или обработанные в электронном виде, не должны преобразовываться в бумажную форму или храниться в ней, если это не соответствует требованиям, изложенным в разделе «Гибридные системы», или если преобразование не валидировано или не проверено на точность (п. 4.26.).
Мастер-документы
Основные документы остались относительно неизменными, в них также включен валидационный мастер-план [8].
В действующей версии Главы 4 этот раздел называется «Документация, требуемая GMP».
Мастер-документ — это первичный, официально утвержденный и контролируемый исходный документ, определяющий основные требования, касающиеся качества, продукции и процессов в организации. Он защищен от несанкционированного доступа или изменения и служит справочным материалом для обеспечения соответствия требованиям, операционной деятельности и подачи документов в регулирующие органы. Необходимо оценивать и проводить регулярный обзор мастер-документов. В п. 4.27. проекта новой версии Главы 4:
- Приведено определение валидационного мастер-плана — документ, описывающий ключевые элементы программы квалификации и валидации площадки.
- Определение спецификации расширено и вынесено в раздел «Глоссарий» — перечень испытаний, ссылки на аналитические процедуры и соответствующие критерии приемлемости, представляющие собой числовые пределы, диапазоны или другие критерии для описываемого испытания. Спецификация устанавливает набор критериев, которым материал должен соответствовать, чтобы считаться приемлемым для предполагаемого использования. «Соответствие спецификации» означает, что материал, испытанный в соответствии с указанными аналитическими процедурами, будет соответствовать указанным критериям приемлемости.
- Изменено определение процедуры — документированный набор инструкций по выполнению и регистрации операций.
- Уточнено определение технического соглашения (также добавлено соглашения по качеству) — письменное подтверждение соглашения между заказчиками и исполнителями относительно работ, переданных на аутсорсинг.
- К определению записи добавлено, что записи могут также существовать в гибридном формате, представляющем собой сочетание бумажных, электронных или иных средств. Полнота и целостность записей, включая все соответствующие исходные данные и метаданные, должны обеспечиваться и защищаться с учетом рисков. Конечно, в проекте новой версии Главы 4 EU GMP нет такого же добавления, как в определении записи в Главе 4 Правил надлежащей производственной практики Евразийского экономического союза (GMP EAЭС) [12]: «Записи, относящиеся к конкретной серии, могут быть собраны в досье на серию». Однако в некоторых разделах и приложениях к EU GMP есть понятие «документации серии» (batch documentation), к которому нет определения. В некоторых англоязычных статьях можно увидеть предложения к такому определению, например, «документация серии представляет собой набор записей, описывающих каждый этап производственного процесса для конкретной серии продукции» [13] и т.п.
В требованиях к спецификациям добавлено, что утвержденные и обновленные спецификации должны быть также на технологические добавки и другие материалы, критически важные для качества, где применимо (4.28.). Указание технологических добавок и других материалов, имеющих отношение к качеству продукции, также должно быть в производственной рецептуре (п. 4.33).
В п. 4.29 написано, что спецификации на исходные материалы, первичные или печатные упаковочные материалы должны включать не просто «ссылки на…» (reference to), а «продукт и его кодовое обозначение» (the product and its reference code), где применимо.
В подпункте f) п. 4.19. Главы 4 GMP EAЭС написано, что инструкции по упаковке среди прочего должны включать в себя требования по проверке того, что оборудование и рабочее место свободны от предыдущей продукции, документов или материалов, ненужных для запланированных операций по упаковке (очистка линии), а также по проверке чистоты оборудования и его готовности к следующему процессу. В том же месте действующей версии Главы 4 EU GMP, как и в подпункте vi. п. 4.35. проекта новой версии Главы 4, говорится о line clearance, то есть о стандартизированной производственной процедуре, обеспечивающей отсутствие всего ненужного, оставшегося от предыдущего процесса. Об этом можно дополнительно прочитать здесь.
В подпункте vii. п. 4.35. проекта добавлено, что инструкции по упаковке должны включать в себя требование о проверке работоспособности любых электронных считывателей кодов, счетчиков этикеток или аналогичных устройств.
Записи по упаковке серии среди прочего должны включать в себя записи проверок того, что оборудование и рабочее место свободны от предыдущей продукции, документов или материалов, ненужных для запланированных операций по упаковке (line clearance), а также по проверке чистоты оборудования и его готовности к следующему процессу, и что любые электронные считыватели кодов, счетчики этикеток или аналогичные устройства функционируют должным образом (подпункт v. п. 4.38).
В п. 4.39. добавлено, что письменные процедуры и подтверждающие записи по приемке должны быть также на образцы для контроля качества. Для этих образцов должны быть в наличии письменные процедуры по внутризаводской маркировке, карантину и хранению (п. 4.40.). Также в пункт 4.39. добавлен подпункт ix. о том, что при необходимости записи по приемке должны содержать подтверждение того, что температура во время транспортировки находилась в пределах допустимых значений. Речь здесь идет об управлении температурой, в том числе в условиях «холодовой цепи» (cold chain). Об этом можно дополнительно прочитать здесь.
В п. 4.43 уточнено, что все записи должны быть доступны уполномоченному лицу на момент принятия решения о выпуске.
Для действий, имеющих отношение к GMP, должны быть в наличии письменно изложенные политики, процедуры, протоколы, отчеты и относящиеся к ним записи предпринятых действий или сделанных заключений, где применимо, в том числе в отношении целостности данных (подпункт iii. п. 4.45.).
Создание и контроль документации
Изменения в содержании здесь необходимы для признания электронных данных и связанных с ними технологий, и необходимости валидации [8].
Технология, гибридное решение или предоставляемая услуга должны быть понятны независимо от их сложности, должны быть оформлены документально и валидированы с помощью риск-ориентированных мер контроля (п. 4.49.).
Должны быть четко определены форматы ввода данных для заполнения документов. Письменные инструкции могут быть дополнены рисунками, фотографиями или видеоматериалами (п. 4.52.). Здесь же делается акцент на том, что документы, содержащие инструкции, должны быть легко доступны в месте выполнения описанных действий.
Выпуск, пересмотр, замена и аннулирование всех документов должны контролироваться путем ведения истории изменений (п. 4.54.). Здесь стоит отметить, что «пересмотр» (revision) ≠ «обзор» (review). Пересмотр — это процесс внесения фактических изменений в текст документа и выпуск его новой версии, в то время как обзор — это плановая проверка актуальности документа без обязательного внесения в него изменений. Даже если инструкции и процедуры регулярно пересматриваются из-за изменений, периодический обзор должен быть регламентирован для обеспечения того, чтобы ни один документ не оставался без внимания в течение длительного времени.
В п. 4.5. Главы 4 GMP EAЭС написано: «Документы в рамках системы управления качеством следует регулярно пересматривать и актуализировать, необходимо исключить использование устаревших версий». В том же пункте действующей версии Главы 4 EU GMP, как и в п. 4.51. проекта новой версии Главы 4, говорится о том, что следует проводить регулярный обзор документов и поддерживать их в актуальном состоянии. На тему разницы в понятиях «пересмотр» и «актуализация» еще 15 лет тому назад писал международный эксперт Александр Александров в статье «Четвертый принцип GMP: Системность документации» [14].
Интересно, что в п. 4.53 всеобъемлющее утверждение о проведении регулярного обзора и актуализации документов в рамках системы управления качеством конкретизировано уже по отношению к инструкциям и процедурам. По мнению старшего консультанта PharmOut Элеанор Реддинг [15], следует считать само собой разумеющимся, что обзор любого документ должен, по сути, включать в себя каждый из его «дочерних» документов — формы, журналы, реестры, контрольные списки и т. д.
Фраза «Документы не должны оформляться в рукописном виде» в новой версии Главы 4 теперь звучит по-другому: «Рукописные инструкции нежелательны» (п. 4.55).
Надлежащая практика ведения документации
Теперь, с учетом ALCOA++, этот раздел позволяет более эффективно использовать возможность определения того, как ввод данных, бумажных или электронных, может быть контролируемым, определенным, гарантированным и точным [8].
Записанные носители должны быть долговечными в течение всего периода хранения. Если это невозможно, то следует создавать подлинные копии. В этом случае должна быть внедрена документированная система для верификации и регистрации целостности копии (п. 4.58.). Должна быть возможность идентифицировать лицо или систему, выполнившие задачу, и время ее выполнения (п. 4.59.).
В новой версии Главы 4 конкретизировано, что любое изменение, вносимое в документ, должно быть подписано лицом, внесшим изменение, и датировано (п. 4.60.). Документация должна представлять собой правдивое и последовательное отражение фактов для обеспечения точности информации, включая данные, используемые для принятия важных решений о качестве продукции (п. 4.61.).
Следует внедрить специальные меры контроля для обеспечения целостности исходных данных и результатов, зафиксированных на бумаге (п. 4.62). К таким мерам могут относиться, помимо прочего:
- контроль за выдачей и использованием разрозненных листов бумаги (пустых бланков) во время записи данных;
- контроль за выдачей переплетенных, пронумерованных блокнотов;
- контроль за выдачей и сверкой последовательно пронумерованных копий пустых бланков с контролем подлинности;
- контроль за тем, чтобы исходные данные одновременно и точно записывались постоянными средствами.
В Академии ECA (European Compliance Academy) считают [16], что контроль за пронумерованными комплектами бланков протоколов испытаний еще не внедрен на практике в систему контроля качества многих компаний, а необходимые для этого дополнительные трудозатраты могут привести к увеличению затрат на контроль качества без существенного улучшения качества.
В разделе теперь представлена таблица с основными принципами целостности данных, применимых как к бумажным, так и к электронным системам, т. е. ALCOA ++: соотносимые, разборчивые, своевременные, подлинные, точные, полные, последовательные, долговечные, доступные и прослеживаемые (п. 4.63.).
В статье «ALCOA++ в GMP: Практическая целостность данных для лабораторий и производства» (ALCOA++ in GMP: Practical Data Integrity for Labs and Manufacturing) [17], опубликованной на портале GMP Insiders, представлена эволюция концепции ALCOA (1990-е гг.), которая была введена для определения основных характеристик надежных данных. С тех пор она развилась в ALCOA+ (середина 2000-х гг.) и, наконец, в ALCOA++ (2010-2020-е гг.), отражая необходимость более жесткого контроля в условиях все более сложной и цифровой среды.
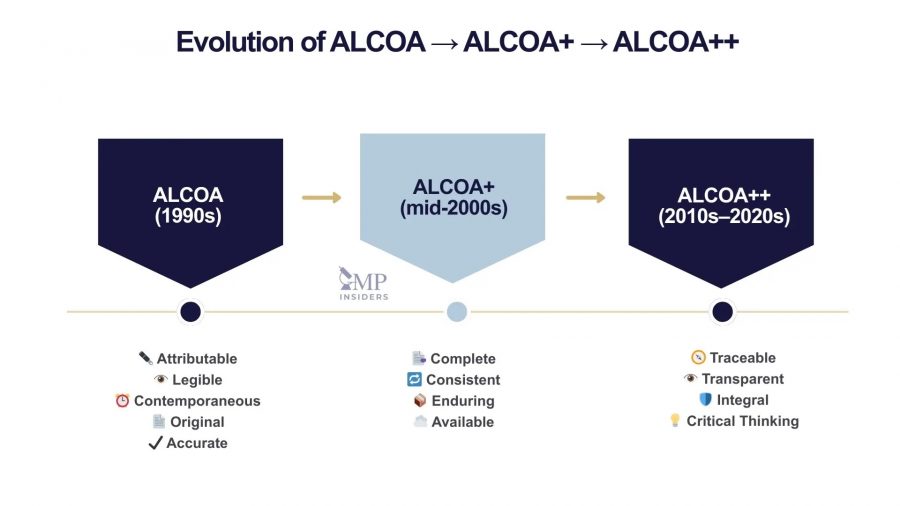
ALCOA++ представляет собой наиболее полное представление о целостности данных. Она применяется ко всем областям GxP, включая производство, контроль качества, клинические исследования и фармаконадзор. В настоящее время эта структура тесно связана с современными нормативными документами, такими как Руководство FDA «Целостность данных и соответствие требованиям CGMP для лекарственных препаратов: вопросы и ответы» (Data Integrity and Compliance With Drug CGMP: Questions and Answers) [18], аналитические документы EMA и рекомендации PIC/S. Некоторые другие принципы ALCOA++, например, прозрачность, целостность и критическое мышление, в новой версии Главы 4 не упоминаются.
Подписи в документации, относящейся к GMP
В ранее не рассматривавшемся в рамках документации разделе были разъяснены цели, законность и контроль подписей [8].
Подпись представляет собой имеющую обязательную юридическую силу волю подписавшего лица. В действующей версии Главы 4 EU GMP подписям не уделено достаточно внимания, в частности они упоминаются в п. 4.3, 4.9, 4.29. Интересно, что в подпункте i. п. 4.20. и п. 4.21 Главы 4 GMP ЕАЭС, которые касаются записей по производству и упаковки серии, написано, что подпись ответственного за процесс лица должна быть «с указанием даты», а в действующей версии Главы 4 EU GMP такого указания нет. При этом в проекте новой версии Главы 4 EU GMP уже четко говорится о том, что подписывающее лицо должно указать дату и время.
Если используются подписи инициалами, должна быть разработана процедура, определяющая сокращенные подписи (п. 4.65.). Должна быть возможность идентификации подписавшего лица (п. 4.66.). Обязанности GMP-регулируемого пользователя должны включать разработку политики использования подписей для обеспечения их надлежащего применения, определение записей, которые требуют юридически обязательной подписи и т. д. (п. 4.67. — п. 4.74).
В п. 4.69. и п. 4.70 проекта Главы 4 упоминаются электронные подписи, при этом следует избегать использования гибридных систем. В пересматриваемом Приложении 11 к EU GMP раздел «Электронные подписи» будет существенно расширен.
Хранение документов
В обновленной Главе еще раз подчеркиваются требования к хранению всех типов записей, а также необходимость резервного копирования, восстановления и архивирования в свете использования электронных данных [8].
В случае электронной записи меры контроля должны включать процедуры резервного копирования, восстановления и архивирования, а также физические и логические средства контроля. Если GMP-регулируемый пользователь использует хостинг-сервисы, он несет ответственность за понимание, утверждение и обоснование мер контроля поставщика хостинг-сервисов на основе соглашения об уровне обслуживания.
Записи должны быть доступны для просмотра в любое время в течение требуемого периода хранения, в удобочитаемом формате для всего соответствующего персонала (п. 4.76.). Должен быть разработан документированный процесс уничтожения документов, гарантирующий, что соответствующие оригиналы документов или подлинные копии уничтожаются только по истечении установленного срока хранения. Должны контролироваться права доступа, позволяющие уничтожать документы (п. 4.79.).
Целостность данных в документации
В этом новом разделе принципы обеспечения целостности данных, уже прочно заложенные в GMP, применяются к системам документации, обеспечивая управление рисками для гарантирования уровня контроля, соответствующего критичности и сложности данных [8].
GMP-регулируемый пользователь должен применять принципы целостности данных, критичности данных и риска для данных в рамках системы управления данными и учитывать полный жизненный цикл данных (п. 4.80.). В этом предложении звучат термины «целостность данных» (data integrity), «критичность данных» (data criticality), «риск для данных» (data risk), «управление данными» (data governance) и «жизненный цикл данных» (data lifecycle), определения которых приведены в разделе «Глоссарий». В глоссарии есть еще один термин, который также может быть переведен как «управление данными» — data management.
Гибридные системы
В этом новом разделе особое внимание уделяется гибридным системам, требующим четкого определения данных и систем, а также последующего снижения рисков [8].
Гибридные системы должны быть четко определены и идентифицированы, а каждый элемент системы, входящий в ее состав, должен быть валидирован и проконтролирован в соответствии с принципами управления рисками (п. 4.82.). Для управления обзором данных, генерируемых гибридными системами, должны быть в наличии процедуры, которые четко описывают процесс оценки, утверждения и архивирования электронных и бумажных данных (п. 4.85.).
Глоссарий
В действующей версии Главы 4 такого раздела не было, а сейчас в глоссарии приведено почти три десятка терминов и определений. Понятие «контролируемая копия» для документа уже не используется, вместо него введен термин true copy — «подлинная копия» (или «верная копия»). Это точная копия оригинального документа, сохраняющая то же содержание, смысл и характеристики, что и оригинал. Термин «подлинная копия» синонимичен терминам «заверенная» или «верифицированная копия». При этом эксперты ECA Academy отмечают [16], что в п. 4.49. еще остался термин «официальная копия», которому не дано определение.
По мнению тех же экспертов [16], впервые четко описанный в GMP секторе термин raw data — «исходные данные», вероятно, приведет к обсуждениям. В глоссарии термин определен как исходная запись (данные), которую можно описать как первое зафиксированное воспроизведение информации, независимо от того, записана она на бумаге или в электронном виде. Информация, первоначально зафиксированная в динамическом состоянии, должна оставаться доступной в этом состоянии.
В глоссарии есть термин regulated user и его определение: держатель регистрационного удостоверения, производители, контрольные лаборатории, импортеры и оптовые дистрибьюторы (если оптовый дистрибьютор имеет лицензию на производство). Этот термин также встречается в п. 3.3 и п. 4.5 действующей версии Приложения 11 к EU GMP [19], но без определения (в п. 3.3. Приложения 11 к GMP EAЭС он переведен как «уполномоченный представитель заказчика», а в п. 4.5 — как «заказчик»). В разделе «Глоссарий» пересмотренной версии Приложения 11 к EU GMP этот термин определен так: компания, деятельность которой регулируется в соответствии с GMP. Наверное, термин можно перевести как «GMP-регулируемый пользователь».
В тексте всего документа есть несколько предложений, которые могут потребовать уточнения. Например, во втором предложении п. 4.28. (Specifications should include all attributes which are relevant for product quality on each stage of material or manufacture), возможно, должно быть «на каждом этапе обработки материала или производства» (…on each stage of material handling or manufacture). Во втором предложении п. 4.79. (Measures should be in place to reduce the risk of deleting the wrong documents), вероятно, должно быть «для снижения риска ошибочного удаления документов» (…to reduce the risk of wrong deleting of documents).
Проект новой версии Главы 4 EU GMP содержит уже не 9, а 17 страниц — примерно половина документа была переписана, добавлены новые разделы. Обновленная Глава 4 не только отвечает на многие вопросы, касающиеся современных технологий, аутсорсинга и целостности данных, но и включает повышенные требования к GMP документации.
Ссылки:
- MHRA / MHRA GMP Deficiency Data 2019. URL: ссылка (дата обращения 04.02.2026)
- EC / Draft guidelines: Revised Chapter 4 — Documentation. URL: ссылка (дата обращения 04.02.2026)
- Quality Vigilance Ltd / From Site Master Files to Quality Manuals: Essential Documentation for GMP Inspection Readiness. URL: ссылка (дата обращения 04.02.2026)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. Part 1. Chapter 4 — Documentation (January 2011). URL: ссылка (дата обращения 04.02.2026)
- EC / Draft guidelines: Revised Annex 11 — Computerised Systems. URL: ссылка (дата обращения 04.02.2026)
- EC / Stakeholders’ Consultation on EudraLex Volume 4 — Good Manufacturing Practice Guidelines: Chapter 4, Annex 11 and New Annex 22. URL: ссылка (дата обращения 04.02.2026)
- GMP Insiders / 2025 EU GMP Draft Updates: Chapter 4, Annex 11, and Annex 22 — What’s Changing? URL: ссылка (дата обращения 04.02.2026)
- PharmOut / Chapter 4: Understanding the Changes to GMP Documentation. URL: ссылка (дата обращения 04.02.2026)
- GMP Insiders / Data Integrity and Data Governance in GMP. URL: ссылка (дата обращения 04.02.2026)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. ICH guideline Q9 (R1) on quality risk management. URL: ссылка (дата обращения 04.02.2026)
- EC / Draft guidelines: Draft guidelines: New annex 22 — Artificial intelligence. URL: ссылка (дата обращения 04.02.2026)
- Евразийский экономический союз / Решение Совета Евразийской экономической комиссии от 03.11.2016 г. № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза». URL: ссылка (дата обращения 04.02.2026)
- BatchLine / Batch documentation in Pharma: What is it and why it’s important? URL: ссылка (дата обращения 04.02.2026)
- ФармПром.РФ / Четвертый принцип GMP: Системность документации. URL: ссылка (дата обращения 04.02.2026)
- PharmOut / Chapter 4 Documentation in Consultation. URL: ссылка (дата обращения 04.02.2026)
- ECA Academy / EMA: Chapter 4 — new Requirements for GMP Documentation? URL: ссылка (дата обращения 04.02.2026)
- GMP Insiders / ALCOA++ in GMP: Practical Data Integrity for Labs and Manufacturing. URL: ссылка (дата обращения 04.02.2026)
- FDA / Data Integrity and Compliance With Drug CGMP: Questions and Answers. URL: ссылка (дата обращения 04.02.2026)
- The rules governing medicinal products in the European Union — Volume 4 — EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. Annex 11: Computerised Systems (revision January 2011). URL: ссылка (дата обращения 04.02.2026)