29-31 октября 2025 г. в Москве проходит Международная специализированная выставка «КормВетГрэйн Экспо 2025». В первый день работы выставки состоялся круглый стол ФГБУ «ВГНКИ» «Государственная регистрация лекарственных препаратов для ветеринарного применения и перспективы развития кормовой отрасли».
На этом круглом столе ведущий специалист Органа инспекции ФГБУ «ВГНКИ» Виктория Хлыновская выступила с презентацией «Особенности инспектирования производителей лекарственных средств для ветеринарного применения». Сначала она представила статистические данные с 2017 года по сегодняшний день:
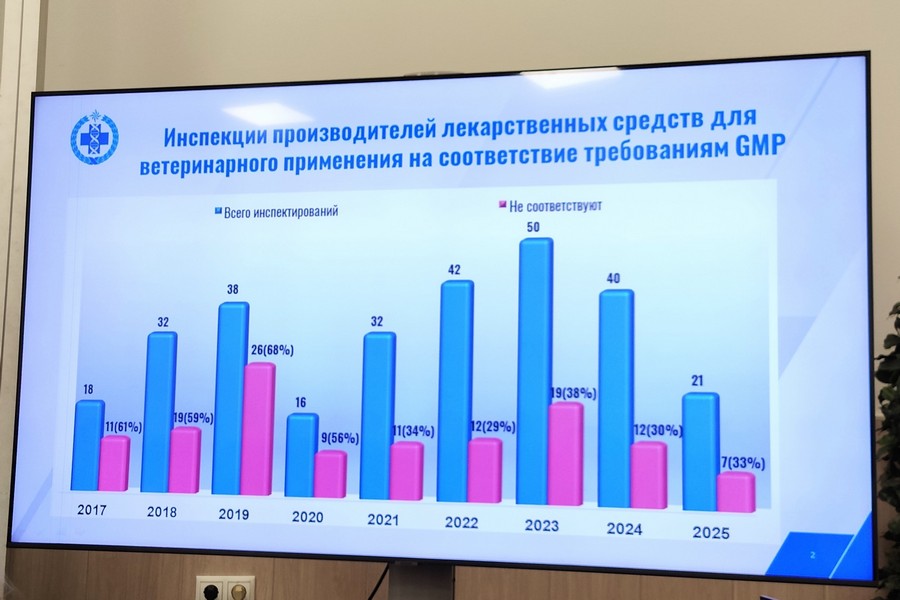
- в 2025 году уже была проведена 21 инспекция иностранных производителей, и по результатам 7 инспекций Россельхознадзором было принято решение об отказе в выдаче заключения о соответствии производителя требованиям правил GMP;
- снижается число отказов в выдаче заключения как в количественном, так и в процентном соотношении по сравнению с начальным периодом проведения инспекций;
- в этом году наблюдается сокращение количества проводимых инспекций, что обусловлено геополитической ситуацией и отказом части европейских и американских производителей от прохождения инспектирования;
- наблюдается рост количества GMP-заявлений от производителей из стран Азии и Латинской Америки (Китай, Южная Корея, Вьетнам, Аргентина, Бразилия, Уругвай);
- в 2025 году уже было проведено 35 проверок отечественных производителей, включая оценку документов по выполнению САРА-планов;
- на сегодняшний день GMP-заключения имеют порядка 60 иностранных и 28 отечественных производителей.
Проведение совместных фармацевтических инспекций по Правилам ЕАЭС планируется с марта 2026 года, сейчас в Комиссии ЕЭК проходят обсуждения процедур, и на сайте Россельхознадзора уже размещен Реестр фармацевтических инспекторов ветеринарного фармацевтического инспектората Российской Федерации.
Виктория Хлыновская напомнила представителям иностранных производителей о том, что:
- коммуникации с Заявителями, составление соглашений по инспектированию, согласование графика инспекций ведут сотрудники Отдела сотрудничества с международными организациями и зарубежными научными учреждениями ФГБУ «ВГНКИ»;
- во время инспекции в состав российской делегации в обязательном порядке включается переводчик, предоставляемый ФГБУ «ВГНКИ», услуги и командировочные расходы которого оплачиваются Заявителем;
- при проведении инспектирования на производственной площадке могут присутствовать представители Управления ветеринарного надзора при экспортно-импортных операциях, на транспорте и международного сотрудничества Россельхознадзора (с целью проведения переговоров с регуляторными органами страны, где находится инспектируемая площадка, а также для регулирования порядка проведения инспекции и, в случае выявления критических несоответствий, для принятия своевременных решений).
С 1 декабря этого года у Органа инспекции появится новая коммерческая услуга — проведение аудитов отечественных производителей лекарственных средств для ветеринарного применения. Кроме того, ФГБУ «ВГНКИ» проводит подготовительные работы для внедрения системы инспектирования производителей дезинфицирующих, дезинсекционных и дезакаризационных средств ветеринарного назначения на соответствие требованиям Решения Совета ЕЭК от 12.12.2023 г. № 150.
В завершении своего выступления спикер обратила внимание производителей на наиболее часто повторяющиеся несоответствия:
- при входном контроле не осуществляется проверка бионагрузки исходного сырья, входящего в состав стерильных лекарственных средств;
- количество контрольных образцов готовой продукции недостаточно для проведения двукратного полного аналитического контроля по всем показателям качества (с учетом стерильности);
- термокартирование складских помещений проводится без учета сезонности, логгеры для рутинного мониторинга устанавливаются не на основании результатов термокартирования;
- валидацию процесса стерилизации не повторяют ежегодно;
- не осуществляется мониторинг частиц во время сборки и наладки оборудования на линиях наполнения стерильных лекарственных средств;
- не валидированы методики контроля качества (испытаний);
- рутинный процесс производства лекарственных средств (асептический розлив) осуществляют операторы, которые участвовали в Media Fill Test более года;
- при выполнении асептических процессов не проводится микробиологический мониторинг всеми предусмотренными способами.

